А.Н. Стрижаков, Ж.А.Каграманова, В.В. Малиновская, В.С. Сускова, Е.Н. Выжлова.
Первый Московский государственный медицинский университет им. И.М. Сеченова.
НИИ эпидемиологии и микробиологии им.Н.Ф. Гамалеи.
ФНЦ трансплантологии и искусственных органов им. В.И. Шумакова.
Представлены результаты комплексного обследования и иммунозаместительной терапии больных воспалительными заболеваниями матки и придатков герпесвирусной этиологии ректальными суппозиториями виферон. Дано иммунопатогенетическое обоснование применения альфа 2b-рекомбинантного интерферона в комплексной терапии воспалительных заболеваний матки и ее придатков герпесвирусной этиологии.
В настоящее время возросла частота урогенитальных инфекций, длительная персистенция которых приводит к развитию хронических воспалительных заболеваний матки придатков (ВЗМП). Ведущая роль в патогенезе ВЗМП герпесвирусной этиологии принадлежит первичному состоянию иммунной системы, что делает важным оценку иммунного статуса с целью коррекции выявленных нарушений звеньев иммунитета. При этом важно учитывать количество и функциональную активность клеток, участвующих в иммунном ответе и системы цитокинов, осуществляющих межклеточные взаимодействия в течение воспалительного процесса для разработки патогенетической иммунотерапии [9,6].
При внедрении инфекции в организме человека развиваются иммунные реакции со сложными клеточными взаимодействиями. Регуляторами этих взаимодействий являются цитокины. Одним из ключевых цитокинов считается интерферон. Существует два типа интерферона: I тип интерферон-альфа (IFN-?)-вирусный или лейкоцитарный, интерферон-бетта (IFN-?) фибробластный и ІI тип интерферон-гамма (IFN-?) иммунный или регуляторный. Все интерфероны обладают противовирусным, иммуномодулирующим, противоопухолевым и антипролиферативным эффектами. Основными клетками продуцентами для (IFN)-? являются лейкоциты, в том числе Т- и В-лимфоциты, макрофаги, дендритные клетки; для (IFN)-? клетки эпителия, фибробласты, Т-лимфоциты, натуральные или естественные киллеры (NK-клетки); (IFN)-? продуцируется Т-лимфоцитами и естественными киллерными клетками. Противовирусный эффект интерферонов заключается в подавлении синтеза вирусной РНК, белков оболочки вируса. Иммуномодулирующий эффект интерферонов связан со способностью регулировать взаимодействие клеток участвующих в иммунном ответе [3,4]. Интерфероны активируют макрофаги, Т-цитотоксические лимфоциты, естественные киллеры (NK-клетки), подавляют активность В-лимфоцитов, активизируют функцию простагландинов и кортикостероидов, опосредованно участвуют в стимуляции активности макрофагов, NK-клеток, Т-цитотоксических лимфоцитов, в усилении экспрессии на клетках молекул гистосовместимости I класса. Антипролиферативный эффект интерферонов заключается в их способности подавлять синтез РНК и протеинов, а так же ингибировать ростовые факторы стимулирующие пролиферацию клеток. Интерфероновый статус отражает функциональное состояние системы интерферонов. Препараты интерферонов обладают универсальным противовирусным эффектом. В результате воздействия интерферонов в клетках организма синтезируются ферменты, которые тормозят образование вирусных белков и разрушают вирусные рибонуклеиновые кислоты. Интерфероны также стимулируют экспрессию антигенов I и II классов главного комплекса гистосовместимости, что изменяет топографию клеточной мембраны, препятствует прикреплению вирусов к клеточной оболочке и нарушает их проникновение внутрь клеток. Кроме того, активизируя цитотоксическую активность Т-лимфоцитов, интерфероны стимулируют лизис клеток, инфицированных вирусами [1,2].
Иммуноглобулины (Ig) или антитела – это особый вид белков, которые вырабатываются под влиянием антигенов и обладают способностью специфически связываться с ними. Иммуноглобулины по своему строению и функции делятся на 4 вида: Ig A, Ig M, Ig G, Ig E. Ig A – синтезируется В-лимфоцитами и составляет 10-15% всех видов иммуглобулинов. Ig A является преобладающим иммуноглобулином секретов. Основной функцией его является защита слизистых оболочек дыхательных, мочеполовых путей и желудочно-кишечного тракта от инфекций. IgМ синтезируется В-лимфоцитами и составляет 5-10% от общего количества иммуноглобулинов. Образуется на ранних стадиях инфекционного процесса (до 5 суток), активирует фагоцитоз и фракции комплемента, нейтрализует вирусы и агглютинирует бактерии. IgG – вырабатываются В-лимфоцитами и составляют 75% всех иммуноглобулинов сыворотки. IgG играют основную роль в формировании длительного гуморального иммунитета после перенесенных инфекционных заболеваний. Основной механизм: формирование комплексов «антиген-антитело».
Цель исследования: разработать и обосновать схемы с использованием заместительной иммунотерапии на основе определения динамики показателей интерферонового, иммунного статуса и цитокинового профиля в стадии обострения и ремиссии воспалительных заболеваний органов малого таза герпесвирусной этиологии.
Пациенты и методы
Проведено клинико-иммунологическое обследование 56 женщин воспалительными заболеваниями матки и ее придатков герпесвирусной этиологии в возрасте от 18 до 45 лет. Основную группу составили 34 женщины с герпесвирусной инфекцией в стадии обострения, группу сравнения – 11 женщин в стадии ремиссии, контрольную группу – 11 женщин (здоровые доноры).
Пациентки основной группы отмечали жалобы на боли внизу живота, подъем температуры тела, общую слабость, снижение работоспособности. При клиническом обследовании выявлено увеличение в объеме и болезненность придатков матки, отечность и гиперемия наружных половых органов, герпетические высыпания на слизистой и коже наружных половых органов.
Диагностика внутриклеточных инфекций методом ПЦР и серодиагностики в периоде обострения заболевания выявила HSV 1 И 2 типов– у 45 пациенток, candida albicans- у 9, ureaplasma urealiticum-у 5, chlamydia trachomatis-у 10, HPV16 ТИП- у 8, CMV- у 9, toxoplasma gondii -у 2 больных.
Методы иммунологического исследования включали: определение показателей клеточного иммунитета методом проточной цитофлуорометрии с использованием МКАТ, (СD3+, CD3+CD4+, CD3+CD8+, иммунорегуляторный индекс (ИРИ) CD4+CD8+, CD3+CD16+CD56+, CD3+HLA-DR+, CD56+HLA-DR+, CD4+CD25+, CD19+, CD95+, CD71+, CD54+ (ООО «Сорбент», Россия). Исследование противоинфекционного иммунитета включало определение метаболической и фагоцитарной активности нейтрофилов с помощью спектрофотометрии (NST-тест). Гуморальное звено иммунитета оценивали по концентрации ЦИК с 6% ПЕГ и сывороточных уровней IgG, IgA, IgM, ЦИК. При оценке цитокинового статуса определяли продукцию про- и противовоспалительных цитокинов в сыворотке крови in vitro методом ИФА (ELISA) (TNFa,IL-1-b,IL-2,IL-6,IL-8) и их баланс до и после иммунотерапии. Цитокины в биологических жидкостях (в эндометрии) (TNFа, IL-1-b, IL-2, IL-6, IL-8, IL-4, ИФН-альфа) определяли методом ИФА (ELISA). Интерфероновый статус включал определение интерфероновой реакции лейкоцитов при индукции вирусом болезни Ньюкасла фитогемаглютинином методом ИФА (интерферон в сыворотке крови, интерферон-альфа, интерферон –альфа, IP-10 (интерферон-альфа индуцибельный протеин -как маркер биологической активности альфа-интерферона). Статистическая обработка проводилась с использованием компьютерной программы Biostat 4,0.
Результаты исследования и их обсуждение
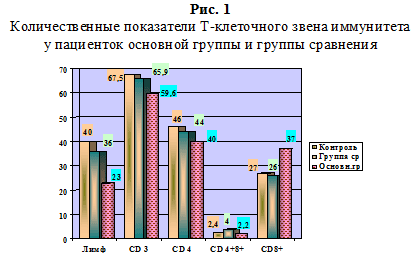
В результате комплексного клинико-анамнестического и иммунологического обследования у больных хронической герпесвирусной инфекцией в стадии обострения (основная группа n=34) отмечена тенденция к снижению общего количества лимфоцитов до (23%) и популяции Т-лимфоцитов (CD3)+ (59,6%), повышение цитотоксических лимфоцитов (CD8)+ до (37%), (в группе сравнения n=11) не превышали референсных значений до (26%), (при норме 27%), а количество незрелых Т-лимфоцитов (CD4+8+) в основной группе было ближе к норме (2,2%).
В основной группе количественные показатели Т-клеточного звена, их иммунорегуляторные субпопуляции (CD4+8+) находились в пределах нормальных значений (2,2%), (в группе сравнения до 4% при норме 2,4%), а количество незрелых клеток (CD4+) – 40% (в группе сравнения 44% при норме до 46%). Это свидетельствовало о недостаточной функции клеточного звена иммунитета на фоне хронической герпесвирусной инфекции.
У 61% пациенток основной группы выявлено нарушение иммунорегуляции по дефицитному типу: иммунорегуляторный индекс (ИРИ) снижен до 1,0 (при норме до 1,5-2,0). В группе сравнения у 20% пациенток показатель ИРИ приближался к нормальным значениям (рис. 1).
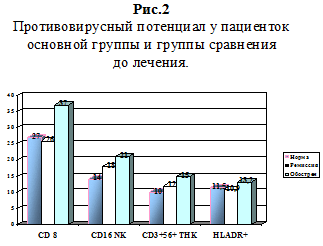
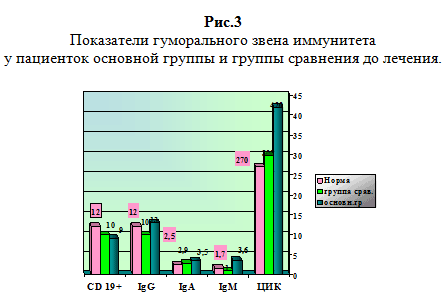
При анализе противовирусного потенциала больных основной группы отмечено повышение (р При исследовании гуморального звена иммунитета IgG колебался в пределах нормы, IgA в основной группе повышался на 20 %, отражая воспаление слизистых оболочек, а в группе сравнения был недостоверно выше нормы (2,9 при норме 2,5). IgM в основной группе повышался в 2 раза (3,6 против нормы 1,7), что соответствовало клинике острого процесса воспаления. Показатели циркулирующих иммунных комплексов (ЦИК) в основной группе были (420 у.е.) выше нормы на 40%, что соответствовало периоду обострения герпесвирусной инфекции, а в группе сравнения показатели ЦИК не отличались от нормы, что соответствовало периоду ремиссии.
Анализируя состояние противоинфекционного иммунитета у пациенток в стадии ремиссии, было выявлено незначительное отклонение от нормы поглотительной способности нейтрофилов и абсолютного фагоцитарного показателя (АФП) нейтрофилов. В основной группе АФП нейтрофилов был выше нормы в 2 раза (15000 при норме 6000-9000). Спонтанная и индуцированная оксидазная активность нейтрофилов в обеих группах повышалась при снижении поглотительной функции нейтрофилов (рис. 3).
Таким образом, высокий уровень спонтанной активности внутриклеточного окислительного метаболизма нейтрофилов по (НСТ) тесту близок к индуцированному, что может указывать на наличие деструктивных процессов в эндотелии сосудов и истощение активности нейтрофилов за счет вирусной инфекции при обострении воспалительного процесса органов малого таза. Индекс стимуляции окислительного метаболизма нейтрофилов у больных в стадии обострения снижен до 1 (при норме 1,7-2,5), что объясняет необходимость усиления бактерицидной активности нейтрофилов с помощью иммунокоррекции.
У пациенток, обследованных в стадии ремиссии хронической герпесвирусной инфекции, на фоне нормальных показателей клеточного звена отмечались незначительные изменения фагоцитарных показателей, в то время как у больных основной группы выявлено снижение общего количества лимфоцитов, Т-лимфоцитов (CD3+4+), повышение количества цитотоксических лимфоцитов (CD8+) и снижение ИРИ Выводы
1. Изучение баланса про- и противовоспалительных цитокинов позволяет определить характер течения и исход острых и хронических воспалительных заболеваний матки и ее придатков герпесвирусной этиологии. Нормализация нарушенного баланса провоспалительных и противовоспалительных цитокинов отмечена у 70% пациенток с хроническими герпесвирусными заболеваниями после иммунозаместительной терапии препаратом виферон.
2. У пациенток в стадии ремиссии на фоне нормальных показателей клеточного звена иммунитета отмечаются незначительные изменения фагоцитарного звена при повышенном количестве фагоцитов, снижении их поглотительной активности (истощение) на фоне ХВЗП на слизистой, что выражено повышением сывороточного IgA в 3 раза, IgG к ВПГ в титрах 12,0.
3. У больных основной группы выявлено повреждение Т-клеточного звена иммунитета, снижение количества с нарушением иммунорегуляции по типу дефицита гуморального звена, повышение функциональной активности фагоцитарной системы, нарушения индуцированной продукции интерферона (IFN-а), которые способствуют развитию осложнений и требуют иммунокорригирующей терапии заместительного типа препаратом виферон (1 000 000МЕ).
4. Цитокинотерапия препаратом виферон повышает эффективность базисной антибактериальной терапии и предупреждает развитие иммунодепрессивного синдрома.
5. Ректальное применение препарата виферон (1000000 ME) способствует более длительной циркуляции в крови интерферона и восстановлению его индуцированной продукции. Иммунокоррекцию следует начинать в период обострения с дозы 1 000 000 ME по 1 ректальному суп¬позиторию 2 раза в сутки ежедневно в течение 20-30 дней с последующими профилактическими курсами.
Литература:
1. Ермольева 3. В., Фурер Н. М.. Фанштейн С. Л. // Проблемы общей вирусологии: Материалы XIX науч. сессии Института вирусологии им. Д. И. Ивановского РАМН. — М..1996. – С. 222-223.
2. Ершов Ф. И., Готовцева Е.П. Белоногова Т. С. и лр. // Ак¬туальные вопросы общей и медицинской вирусологии: Сборник науч. трудов Института вирусологии им. Д. И.Ивановского РАМН. – М., 1996. – С. 43-44.
3. Каграманова Ж.А., Малиновская В.В., Выжлова Е.Н., «Клинико-иммунологическое обоснование иммунотерапии больных острым воспалительным заболеванием придатков матки» статья в журнале Российский вестник акушера – гинеколога №5, т. 6, 2006 г.-С. 29-33.
4. Каграманова Ж.А., Малиновская В.В. «Обоснование иммунотерапии воспалительных заболеваний придатков матки», в Сборнике тезисов 2-й Российской школы по иммунотерапии, Новороссийск, 2005г.-С. 136.
6. Караулов А.В., Афанасьев М.С., Алешкин В.А., Афанасьев С.С., Воропаева Е.А. «Колонизационная резистентность слизистых цервикального канала как неотъемлемая составляющая местного иммунитета». Иммунология, 2011, Т.32, № 1, С. 11 – 15. Т.Е.
7. Полеско И. П., Ьутов Ю. С, Малиновская В. В., Халдин А. А. //VII Рос. журнал кож. и вен. бол. — 2001. — № 2. — С. 31—36.
8. Polesko I. V., Khaldin A. A., MalinovskayaV.V., Butov Y. S. // 3-rd Joint Meeting of ICS/1SICR. – Amsterdam, 2000. -P. 193.
9. Paladino P.,Mossman K.L. Mechanisms employed by Herpes simplex virus 1 to inhibit the interferon response//J.Interferon Cytokine Res.-2009.-Vol.29,№9-P.599-607.