Р.Р. Климова, В.В. Малиновская, Е.Н. Выжлова, Ю.А. Тюленев, А.А. Кущ.
ФГУ “НИИ вирусологии им. Д.И. Ивановского” Минздравсоцразвития России, Москва.
ФГУ “НИИ микробиологии, эпидемиологии и иммунологии им. Н.Ф. Гамалеи” Минздравсоцразвития России, Москва.
Вирус простого герпеса (ВПГ) и цитомегаловирус (ЦМВ) чрезвычайно широко распространены в человеческой популяции и могут поражать различные органы и ткани. Особую опасность ВПГ- и ЦМВ-инфекции представляют для беременных женщин и для новорожденных детей. Основными недостатками противовирусных химиопрепаратов являются их высокая токсичность, ограниченная биодоступность и при длительном использовании – развитие лекарственной устойчивости. В настоящее время проводится поиск новых средств и новых схем терапии, позволяющих избежать проявления побочных токсических эффектов при сохранении высокой противовирусной эффективности.
Целью настоящего исследования была оценка эффективности схемы мультимодальной терапии герпесвирусной инфекции новой лекарственной формой (НЛФ) ВИФЕРОН®, раствор для местного применения в сочетании со специфическими противовирусными химиопрепаратами in vitro и in vivo. Впервые установлено, что использование НЛФ в концентрации 20 000 МЕ/мл ингибирует ЦМВ-инфекцию в терапевтической схеме in vitro на 83%. Показано, что НЛФ усиливает специфическую противовирусную активность химиопрепаратов, позволяя значительно снизить эффективную ингибирующую концентрацию последних: для ГЦВ – в 3 раза, для АЦВ – в 20 раз. В экспериментах in vivo продемонстрировано, что НФЛ не оказывает токсического действия на организм животных. Однократно введение НФЛ через 24 ч после внутрибрюшинного заражения мышей ВПГ1 защищает 60% животных от летальной (20 ЛД50) герпесвирусной инфекции. Комбинированное использование НФЛ и АЦВ в лечебной схеме in vivo позволило: а) уменьшить дозы обоих препаратов в 10 раз (до 2000 МЕ/мл и 5 мг/кг соответственно) по сравнению с применением каждого препарата в отдельности; б) достичь лечебного эффекта при использовании короткой схемы терапии – 3 сут.; в) обеспечить полную защиту (100%) животных от летального заражения (20 ЛД50/мл) ВПГ1. Высокий протективный эффект мультимодальной терапии летальной герпесвирусной инфекции in vivo обусловлен синергидным характером взаимодействия использованных препаратов.
Введение
Вирус простого герпеса (ВПГ) и цитомегаловирус (ЦМВ) чрезвычайно широко распространены в человеческой популяции и могут поражать различные органы и ткани. У лиц со сниженным иммунитетом герпесвирусные инфекции (ГВИ) часто приводят к тяжелым осложнениям, нередко – со смертельным исходом. Особую опасность ВПГ- и ЦМВ-инфекции представляют для беременных женщин и для новорожденных детей. В настоящее время существует несколько патентованных лекарственных препаратов, применяемых при лечении герпесвирусных инфекций, однако большинство из них не разрешены для лечения беременных женщин и новорожденных детей [1]. Основными недостатками химиопрепаратов являются их высокая токсичность, ограниченная биодоступность и при длительном использовании – развитие лекарственной устойчивости [2]. В связи с этим в настоящее время проводится поиск новых средств и новых схем терапии, позволяющих избежать проявления побочных токсических эффектов при сохранении высокой противовирусной эффективности. Одно из направлений, развиваемых в этой области исследований, состоит в разработке принципов мультимодальной терапии, значение которой заключается в одновременном воздействии на различные функции организма больного. В связи с этим для лечения герпесвирусных инфекций представляло интерес изучить эффективность комбинированного применения препаратов, содержащих интерферон альфа-2b в комплексе с антиоксидантами иммуномодулятора виферон и специфических химиопрепаратов. Интерферон альфа-2b обладает широким спектром противовирусной активности, а также иммуномодулирующими и антипролиферативными свойствами. В настоящий момент на территории России зарегистрирован препарат ВИФЕРОН®, содержащий интерферон альфа-2b в комплексе с антиоксидантами в различных лекарственных формах (суппозитории ректальные, мазь для наружного и местного применения, гель для наружного и местного применения). Препараты под торговым наименованием ВИФЕРОН®, разрешены для лечения широкого спектра заболеваний у взрослых и детей, в том числе у беременных женщин и новорожденных детей. Недавно была разработана новая лекарственная форма (НЛФ) – ВИФЕРОН®, раствор для местного применения, включающая интерферон альфа-2b человеческий рекомбинантный, комплекс антиоксидантов и вспомогательные вещества. Ранее была показана активность НЛФ против ВПГ-инфекции в клеточной системе in vitro при профилактическом использовании [3, 4].
Целью настоящего исследования была оценка эффективности схемы мультимодальной терапии герпесвирусной инфекции НЛФ ВИФЕРОН®, раствор для местного применения в сочетании со специфическими противовирусными химиопрепаратами in vitro и in vivo.
Материалы и методы
Мыши
. Опыты проводили на мышах линии DBA, самках с массой тела 18-22 г, полученных из Центрального питомника лабораторных животных “Крюково” РАМН.
Культуры клеток. В работе использовали первичную культуру диплоидных фибробластов легкого эмбриона человека (ФЛЭЧ) и перевиваемую линию клеток Vero, полученные из лаборатории клеточных культур ФГУ “НИИ вирусологии им. Д.И. Ивановского” Минздравсоцразвития России. Клетки ФЛЭЧ культивировали на среде DMEM (“ПанЭко”, Россия), клетки Vero – в среде Игла MEM (“ПанЭко”, Россия) с добавлением 10% эмбриональной телячьей сыворотки (ЭТС, “ПанЭко”, Россия), 2мМ L-глутамина (“ПанЭко”, Россия), 50 мкг/мл гентамицина (“ПанЭко”, Россия).
Вирусы. Использовали референс-штамм ЦМВ человека AD 169 и референс-штамм F ВПГ1, любезно предоставленные проф. D. Emanuel (США) и проф. L. Pereira (США), соответственно. ЦМВ размножали и титровали на культуре клеток ФЛЭЧ, ВПГ – на культуре клеток Vero по общепринятой методике.
Определение инфекционной активности ВПГ и ЦМВ. Инфекционный титр ВПГ и ЦМВ определяли в культуре клеток модифицированным методом бляшек. Для титрования готовили образцы вируса и вносили в 96-луночные планшеты с монослоем клеток Vero (ВПГ) или ФЛЭЧ (ЦМВ). Панели с материалом инкубировали при 37°С в течение 7 дней. Очаги инфицированных клеток (бляшки) выявляли иммуноцитохимическим методом с использованием моноклональных антител (МКА) к белкам ВПГ или ЦМВ [5, 6]. Титр вируса определяли по формуле А=аxb/v, где А – число бляшкообразующих единиц на клетку в 1 мл (БОЕ/мл); a – среднее число бляшек на одну лунку; b – разведение вируса; v – объём вносимого вируссодержащего материала. Титр вируса составлял, в среднем, 1х107 БОЕ/мл для ВПГ и 1х105 БОЕ/мл для ЦМВ.
Препараты. В работе использовали следующие препараты: Ганцикловир (ГЦВ, Цимевен®, Роше, Швейцария), исходная концентрация 500 мг/мл; Ацикловир (АЦВ, Зовиракс®, ГлаксоСмитКляйн Вэллком, Великобритания), исходная концентрация 250 мг/мл; интерферон альфа-2b (НЛФ, ВИФЕРОН®, раствор для местного применения, 40000 МЕ/мл, ООО “ФЕРОН”, Россия). Препарат ВИФЕРОН®, раствор для местного применения в качестве действующего вещества содержит интерферон альфа-2b человеческий рекомбинантный 40000 МЕ/мл, а также компоненты, обладающие антиоксидантными свойствами: димеркаптопропансульфонат натрия (унитиол) и моногидрат лимонной кислоты и другие вспомогательные вещества.
Определение цитотоксичности исследуемых препаратов. Оценку цитотоксичности исследуемых препаратов проводили следующим образом: к сформированному на стандартных 96-луночных планшетах клеточному монослою добавляли последовательные разведения приготовленных растворов исследуемых препаратов с конечной концентрацией 2.0, 1.5, 1.0, 0.5, 0.1 мг/мл для ГЦВ и АЦВ и 5 000, 10 000, 20 000 и 40 000 МЕ/мл для НЛФ. За 50% тканевую цитотоксическую дозу (ЦД50) принимали такую концентрацию препарата, которая вызывала гибель 50% клеток на третьи сутки после внесения образцов.
Оценка противовирусного действия препаратов in vitro. Противовирусную активность препаратов анализировали в лечебной схеме. Химиопрепараты (ГЦВ и АЦВ) изучали в 5 концентрациях: 100, 10, 1.0, 0.2 и 0.1 мкг/мл. НЛФ исследовали в двух концентрациях: 20000 и 10000 МЕ/мл. Для определения противовирусной активности препаратов клетки ФЛЭЧ заражали ЦМВ с инфекционной множественностью (ИМ) 0.01 БОЕ/мл, клетки Vero – ВПГ1 с ИМ 0.001 БОЕ/мл. Для оценки комбинированного противовирусного эффекта препараты вносили в различных концентрациях и сочетаниях. В качестве контроля использовали зараженные клетки, не обработанные препаратами. Противовирусную активность веществ определяли по степени ингибирования ЦПД вирусов, которую выражали в %. Концентрацию соединения, подавляющую ЦПД на 50% по отношению к контролю, принимали за ингибирующую дозу (ИД50). Индекс селективности (ИС) рассчитывали как отношение ЦД50 к ИД50.
Анализ токсичности НЛФ in vivo изучали на беспородных мышах при интраназальном введении в концентрации 4000 МЕ/мышь, при внутрижелудочном введении в концентрации 10000 МЕ/мышь и внутрибрюшинном введении в концентрации 20000 МЕ/мышь. В каждой группе использовали по 12 животных. Анализировали следующие показатели: масса тела, гибель и общее состояние животных, гематологические и биохимические показатели крови, анализ мочи и патоморфологическое исследование органов и тканей. Животных наблюдали в течение 28 сут.
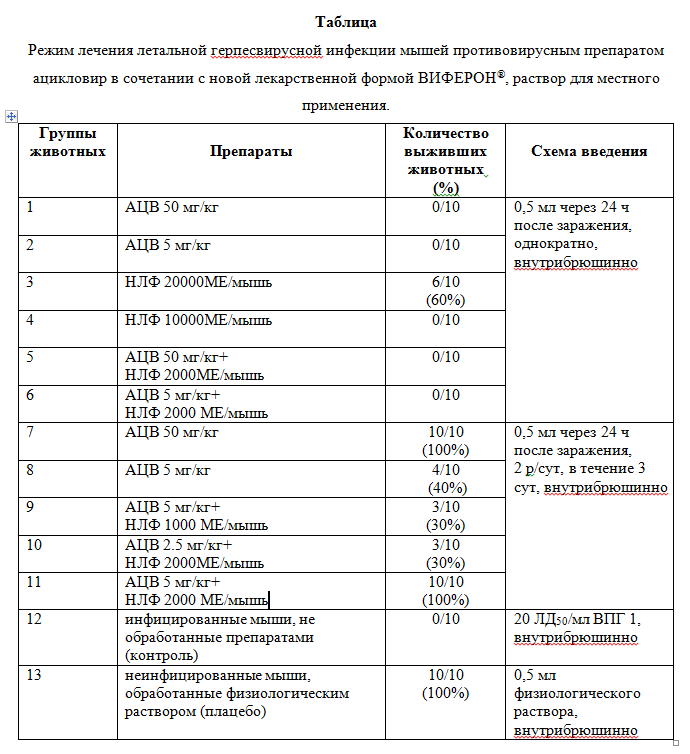
Изучение протективных свойств препаратов in vivo. Защитное действие препаратов против ВПГ исследовали в лечебной схеме, используя 13 групп животных по 10 мышей линии DBA в каждой группе. Мышей заражали внутрибрюшинно ВПГ1, вводя по 20 пятидесятипроцентных летальных доз в 1 мл (20 ЛД50/мл). Лечение начинали через 24 часа. Количества препаратов и продолжительность их введения представлены в разделе “Результаты”. Лечебные свойства оценивали по способности исследуемого вещества защищать животных от летального заражения ВПГ1. Наблюдение проводили в течение 21 дня.
Определение противовирусной активности комбинации АЦВ и НЛФ in vivo. Концентрации одного вещества и другого в комбинации и по отдельности, которые приводили к 50% защите животных, обозначали как 50%-ная эффективная доза (ЭД50). Для оценки эффективности комбинации использовали понятие индекса суммарной фракционной ингибирующей концентрации (ФИК), значение которого вычисляли по формуле: индекс ФИК=ФИКА+ФИКБ, где ФИКА равен отношению ЭД50АЦВ в комбинации к ЭД50 АЦВ, ФИКБ равен отношению ЭД50 НЛФ в комбинации к ЭД50 НЛФ.
Статистический анализ. Статистическую обработку результатов осуществляли, применяя двусторонний точный критерий Фишера и критерий ?2. Различия показателей считали статистически значимыми при р
Результаты
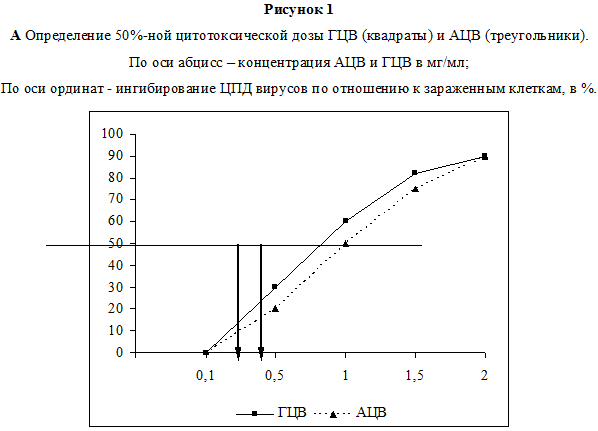
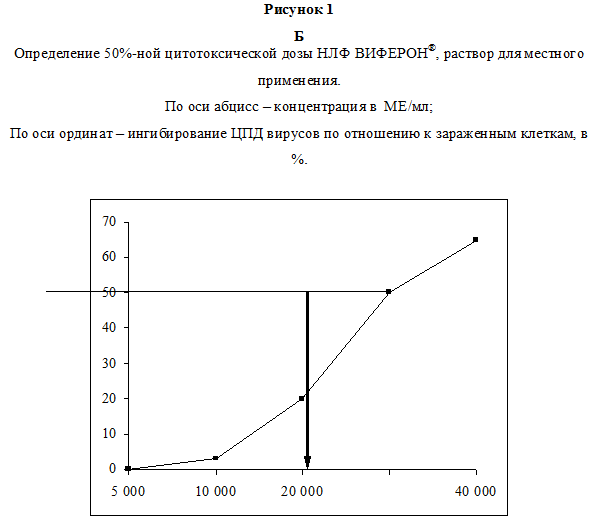
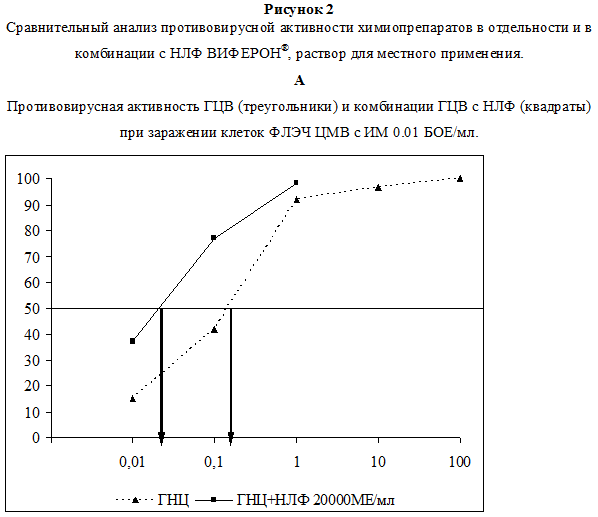
В первой серия экспериментов была изучена цитотоксичность используемых препаратов in vitro. Данные по оценке ЦД50 для каждого из исследованных соединений представлены на рис. 1. Показано, что в условиях наших опытов ЦД50 для ГЦВ, рассчитанная по графику, составила 0.89 мг/мл, для АЦВ – 1.1 мг/мл (рис. 1А), для НЛФ – 30000 МЕ/мл (рис. 1Б). Методика определения противовирусной активности препаратов изложена в разделе Материалы и методы. Анализ противовирусного действия показал, что оба химиопрепарата в максимальной изученной концентрации (100 мкг/мл) полностью подавляли ЦПД вирусов (рис. 2 А, Б). ИД50, рассчитанная по графику, для ГЦВ составила 0.12 мкг/мл (рис. 2А), для АЦВ – 0.7 мкг/мл (рис. 2Б). ИС для ГЦВ составил 7417, для АЦВ – 1571. Однократное введение НЛФ в концентрациях 10000 и 20000 МЕ/мл вызывало подавление ЦМВ-инфекции на 83% и 88%, соответственно, подавление ВПГ-инфекции – на 45% и 65%, соответственно. ИД50 для НЛФ против ВПГ составила 12500 МЕ/мл.
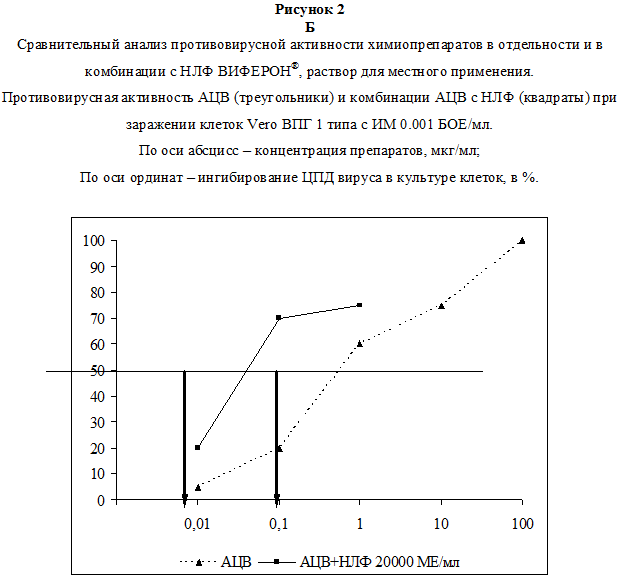
В следующей серии опытов изучали эффективность комбинаций препаратов. Химиопрепараты использовали в низких концентрациях (1.0, 0.2, 0.1 и 0.01 мкг/мл), НЛФ – в концентрациях 20000 и 10000 МЕ/мл. Было установлено, что добавление НЛФ в концентрации 20000 МЕ/мл к ГЦВ в концентрации 0.1 мкг/мл увеличивало противовирусное действие последнего с 42% до 77% (рис. 2А). При добавлении НЛФ в той же концентрации к ГЦВ в концентрации 0.01 мкг/мл, увеличивало ингибирующий эффект с 15% до 35%. Эффект сочетанного действия ГЦВ и НЛФ против ЦМВ-инфекции в обоих вариантах опыта был статистически значимо выше по сравнению с действием одного ГНЦ (р Следующая часть работы была посвящена изучению противовирусного действия данных соединений in vivo – на модели экспериментальной инфекции лабораторных животных. Сочетанное действие препаратов тестировали в отношении летальной инфекции, вызванной ВПГ1 у мышей.
На первом этапе исследовали токсичность НЛФ. Показано, что НЛФ при однократном (острая токсичность) интраназальном, внутрижелудочном и внутрибрюшинном введении в концентрациях 4000, 10000 и 20000 МЕ/мышь соответственно не обладала токсическим действием на организм животных. При изучении токсичности при повторном введении в течение 15 дней (подострая токсичность) не было установлено видимых признаков изменения общего клинического состояния. На протяжении курса введения и в период отмены динамика изменения массы тела животных была положительной. При проведении клинических лабораторных исследований не было установлено влияния НЛФ на состав периферической крови и показатели мочи животных. В результате проведенного патоморфологического исследования не установлено морфологических изменений в органах и тканях мышей. В дальнейших экспериментах использовали концентрации НЛФ, не превышающие уровней, испытанных при анализе токсичности.
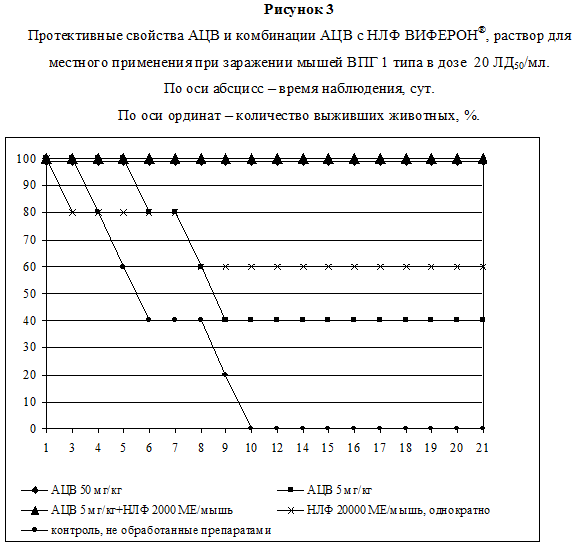
Противовирусные свойства препаратов анализировали в лечебной схеме. Схема, сроки и результаты терапии представлены в таблице. Наиболее выраженный протективный ответ представлен на рис. 3. Из таблицы видно, что в контрольной группе 12 в течение 10 дней после заражения погибли все 100% (10/10) животных. Все животные группы 13 оставались живыми в течение 21 дня опыта и в следующие 30 дней (время наблюдения). Однократное введение НЛФ в концентрации 20000 МЕ/мышь (группа 3) привело к защите 60% (6/10) животных, однако различия оказались статистически незначимыми, р=0.087 (таблица, рис. 3). В группах 1, 2, 4, 5 и 6 терапевтический эффект выявлен не был. Применение в группе 7 более длительной схемы терапии (50 мг/кг АЦВ каждые 12 часов в течение 3 сут) привело к 100% (10/10) защите животных (таблица). Использование АЦВ в концентрации 5 мг/кг в 3-х дневной схеме – защищало 40% (4/10) животных группы 7 (таблица, рис.3). У животных групп 9 и 10 наблюдали 30%-ный протективный эффект. Совместное применение НЛФ в концентрации 2000 МЕ/мышь и АЦВ в концентрации 5 мг/кг (группа 11) позволило статистически значимо увеличить защитный эффект с 40% до 100%, р=0.11 (таблица, рис. 3). Рассчитанная по графику ЭД50 для АЦВ составила 12.5 мг/кг, а в сочетании с НЛФ – 3 мг/кг, ФИКА равна 0.24. Для НЛФ значение ЭД50 составило 18333 МЕ/мышь, а в сочетании с АЦВ – 1090 МЕ/мышь, ФИКБ равна 0.06. На основе полученных результатов было определено значение индекса ФИК для двух изученных препаратов, которое составило 0.3, что свидетельствует о синергидном действии препаратов. Таким образом, снижение концентраций АЦВ и НЛФ в 10 раз при совместном введении в течение 3-х дней обеспечивало 100%-ую защиту экспериментальных лабораторных животных от летального заражения ВПГ1 в дозе 20 ЛД50/мл.
Обсуждение
В настоящее время АЦВ, специфически ингибирующий активность вирусной ДНК-полимеразы, является препаратом выбора для лечения ВПГ-инфекции у новорожденных детей. Длительность лечения составляет 14 сут при инфицировании кожи, глаз и/или ротовой области и 21 сут для лечения генерализованной инфекции и заболеваний ЦНС [7]. Несмотря на то, что при использовании данной терапии смертность от энцефалитов снижается до 15%, только 50% выживших детей развиваются нормально [8]. В связи с токсичностью ГЦВ, важной проблемой является выбор адекватного курса терапии новорожденных, в том числе недоношенных, с ЦМВ-инфекцией [9]. Хорошие результаты дает препарат Цитотект® (“Biotest Pharma”, Германия), содержащий антитела к ЦМВ, однако этот импортный препарат является дорогостоящим и малодоступным. В настоящее время накоплен опыт лечения ЦМВ-инфекции препаратами иммуноглобулинового ряда (пентаглобин), лекарственными средствами на основе цитокинов (виферон, ронколейкин), индукторов интерферона (неовир, циклоферон). Однако, несмотря на лечение этими препаратами смертность от генерализованной неонатальной герпесвирусной инфекции остается высокой, составляя от 40% до 65% [10].
В ряде исследований предприняты попытки усилить терапевтическое действие патентованных химиопрепаратов, противовирусное действие которых хорошо изучено. К этому побудили не только данные о токсическом действии этих препаратов, но также сведения о том, что задержка с началом лечения тяжелых форм ВПГ-инфекции даже на 24 ч делает использование АЦВ мало эффективным. Недавно было изучена противовирусная активность новых соединений: ингибитора тимидинкиназы и геликаза-праймазного комплекса ВПГ [8, 11]. Комбинированное действие ингибиторов с АЦВ защищало мышей от герпетического энцефалита. И хотя в опытах использовали относительно высокие дозы препаратов, авторы полагают, что дальнейшие исследования в этом направлении перспективны. Ранее в работе Т. Спектор и соавторов было установлено, что инактиватор еще одного фермента ВПГ – рибонуклеотид редуктазы – усиливает действие АЦВ против ВПГ [12]. Поиск новых молекулярных мишеней проводится и в отношении ЦМВ-инфекции, однако ингибиторы вирусной протеинкиназы UL97 и терминазы ЦМВ не дали обнадеживающих результатов при клинических испытаниях [13, 14]. В настоящей работе был использован другой подход, направленный не на расширение спектра ингибиторов вирусных ферментов, а на разработку комплексной терапии, включающей препараты, воздействующие как на вирус, так и на инфицированный организм. Основным действующим компонентом НЛФ является ИФН-?2b – полифункциональный цитокин, который индуцирует экспрессию генов системы ИФН и оказывает иммуномодулирующее и противовирусное действие. Кроме того, препарат содержит два антиоксиданта (унитиол и лимонную кислоту), препятствующих повреждающему действию свободнорадикального окисления. Ранее было установлено, что комбинация из этих двух антиоксидантов с ИФН-?2b позволяет усилить противовирусную активность ИФН-?2b в опытах in vitro в несколько раз [15].
В настоящей работе впервые показана высокая активность НЛФ против ЦМВ-инфекции. Следует отметить, что эффективность НЛФ в подавлении ЦМВ-инфекции превосходила таковую против ВПГ-инфекции почти в 2 раза (83% против 45%). Больший терапевтический эффект НЛФ, полученный при ЦМВ-инфекции по сравнению с ВПГ-инфекцией возможно связан с различиями в жизненном цикле обоих вирусов. Известно, что ЦМВ-инфекция развивается медленнее, чем ВПГ-инфекция. В культуре клеток первые инфекционно активные вирионы ЦМВ высвобождаются из клеток через 96 ч после инфицирования, тогда как вирионы ВПГ – через 8 ч [16]. НЛФ, внесенный через 24 ч после заражения клеток ЦМВ, по-видимому, воздействует на более ранние стадии вирусной инфекции, предшествующие репликации вирусной ДНК, запуская ряд механизмов, эффективно ингибирующих вирусное ЦПД. АЦВ и ГЦВ в составе комплексной терапии с иммунопрепаратом подавляют репликацию вирусной ДНК, дополняя и усиливая действие каждого из компонентов отдельности. В пользу этого предположения свидетельствуют данные анализа эффективности сочетанного действия КП с химиопрепаратами in vitro [15]. В настоящей работе в опытах на клеточных культурах это заключение нашло подтверждение на примерах ВПГ- и ЦМВ-инфекций: было показано, что сочетанное применение НЛФ и химиопрепаратов позволяет значительно снизить эффективную концентрацию последних.
Наиболее важной характеристикой любого исследуемого препарата является его низкая токсичность и способность защищать зараженный организм от летальных доз вируса. В настоящей работе показано, что НЛФ в максимальной изученной концентрации (20000 МЕ/мышь) не обладает токсическим действием на животных при различных способах введения. Впервые показано, что даже однократное введение НЛФ в концентрации 20000 МЕ/мышь, защищает 60% мышей, а в комбинации с АЦВ – 100% мышей от 20 ЛД50 ВПГ 1 типа. Наибольший протективный эффект был достигнут при 3-х дневном комплексном лечении животных. При этом удалось снизить дозу обоих соединений в 10 раз по сравнению со стандартной схемой терапии АЦВ, используемой при лечении более легких форм ВПГ-инфекции у животных [8, 17]. Ранее было установлено, что НЛФ в сочетании со специфическими химиопрепаратами оказывают синергетическое действие в отношении ряда вирусных инфекций in vitro [15]. Представляло интерес выяснить характер взаимодействия препаратов в ситуации in vivo. Было определено значение индекса ФИК, которое составило 0.3. Согласно имеющимся данным, значения индекса ФИК меньшее или равное 0.5 свидетельствует о синергидном характере взаимодействия изученных препаратов [18].
Таким образом, показанная в данной работе возможность комбинирования новой лекарственной формы ВИФЕРОН®, раствор для местного применения, 40000 МЕ/мл, ООО «ФЕРОН», Россия с химиопрепаратами дает основание для разработки новых схем мультимодальной терапии герпесвирусных инфекций человека, позволяющих снизить терапевтические концентрации лекарственных соединений, сократить продолжительность лечения и, следовательно, избежать проявления побочных токсических эффектов при сохранении высокой противовирусной эффективности.
Выводы
1. Впервые установлено, что НЛФ ВИФЕРОН®, раствор для местного применения в концентрации 20000 МЕ/мл на 83% ингибирует ЦМВ-инфекцию в терапевтической схеме in vitro.
2. Показано, что НЛФ препарата ВИФЕРОН®, раствор для местного применения усиливает специфическую противовирусную активность химиопрепаратов в лечебной схеме in vitro, позволяя значительно снизить эффективную ингибирующую концентрацию последних: для ГЦВ – в 3 раза, для АЦВ – в 20 раз.
3. В экспериментах in vivo продемонстрировано, что НЛФ препарата ВИФЕРОН®, раствор для местного применения, однократно введенный через 24 ч после внутрибрюшинного заражения мышей ВПГ1, защищает 60% животных от летальной (20 ЛД50/мл) герпесвирусной инфекции.
4. Использование НЛФ препарата ВИФЕРОН®, раствор для местного применения в сочетании с АЦВ в лечебной схеме in vivo позволило: а) уменьшить дозы обоих препаратов в 10 раз (до 2000 МЕ/мл и 5 мг/кг, соответственно) по сравнению с применением каждого препарата в отдельности; б) достичь лечебного эффекта при использовании короткой схемы терапии – 3 сут.; в) обеспечить полную защиту (100%) животных от летального заражения (20 ЛД50/мл) ВПГ1.
5. Высокий протективный эффект мультимодальной терапии летальной герпесвирусной инфекции in vivo обусловлен синергидным характером взаимодействия использованных препаратов.
Литература
1. Scott H.J., Kimberlin D.W., Whitley R.J. Antiviral Therapy for Herpesvirus Central Nervous System Infections: Neonatal Herpes Simplex Virus Infection, Herpes Simplex Encephalitis, and Congenital Cytomegalovirus Infection. Antiviral Res 2009; 83(3): 207–213.
2. Naesens L., De Clercq E. Recent developments in herpesvirus therapy. Herpes 200; 8(1):12-16.
3. Выжлова Е.Н., Андронова В.Л., Галегов Г.А., Малиновская В.В. Комбинированное антигерпесвирусное действие комплексного препарата “Виферон – капли глазные” и модифицированных нуклеозидов. Бюллетень экспериментальной биологии и медицины 2006; 141(6): 672-676.
4. Evgenia N. Vyzhlova, Valeria L. Аndronova., Georgiy A. Galegov., Valentina V. Malinovskaya. Synergistic antiherpesviral combination of alpha interferon and nucleoside analog or pyrophosphate analog in relation to herpes simplex virus in cell culture in vitro. Journal of interferon and cytokine research 2007; 27(8): 737-738.
5. Климова Р.Р., Масалова О.В., Атанадзе С.Н. и др. Получение и свойства моноклональных антител к вирусу герпеса 1 и 2 типа. Журн микробиол 1999; 5: 99-103.
6. Макарова Н., Кущ А., Иванова Л. и др. Получение моноклональных антител к сверхранним белкам цитомегаловируса человека и их применение для выявления инфицированных клеток. Вопр Вирусол 1996; 1: 28-32.
7. Kimberlin D.W. Management of HSV encephalitis in adults and neonates: diagnosis, prognosis and treatment. Herpes 2007; 14(1): 11-16.
8. Gebhardt B.M., Focher F., Eberle R. et al. Effect of combinations of antiviral drugs on herpes simplex encephalitis. Drug Des Devel Ther 2009; 3: 289-294.
9. Michaels M.G. Treatment of congenital cytomegalovirus: where are we now? Expert Rev Anti Infect Ther 2007; 5(3): 441-448.
10. Khetsuriani N., Holman R.C., Anderson L.J. Burden of encephalitis-associated hospitalizations in the United States, 1988-1997. Clin Infect Dis 2002; 35:175-182.
11. Field H.J., Biswas S. Antiviral drug resistance and helicase-primase inhibitors of herpes simplex virus. Drug Resist Updat 2010 [Epub ahead of print].
12. Spector T., Harrington J.A., Morrison R.W. et al. 2-Acetylpyridine 5-[(dimethylamino)thiocarbonyl]-thiocarbonohydrazone (A1110U), a potent inactivator of ribonucleotide reductases of herpes simplex and varicella-zoster viruses and a potentiator of acyclovir. Proc Natl Acad Sci USA 1989; 86(3): 1051-1055.
13. Lischka P., Zimmermann H. Antiviral strategies to combat cytomegalovirus infections in transplant recipients. Curr Opin Pharmacol 2008; 8(5): 541-548.
14. Lischka P., Hewlett G., Wunberg T. et al. In vitro and in vivo activities of the novel anticytomegalovirus compound AIC246. Antimicrob Agents Chemother 2010; 54(3): 1290-1297.
15. Выжлова Е.Н. Антивирусная активность новой лекарственной формы интерферона для местного применения. Автореферат. дисс… к.б.н. Москва 2008.
16. Smith J.D., De Harven E. Herpes simplex virus and human cytomegalovirus replication in WI-38 cells. I. Sequence of viral replication. J Virol 1973; 12(4): 919-930
17. Farley N., Bernstein D.I., Bravo F.J. et al. Recurrent vaginal shedding of herpes simplex type 2 virus in the mouse and effects of antiviral therapy. Antiviral Res 2010; 86(2):188-195.
18. Lampi G., Deidda D., Pinza M. et al. Enhancement of anti-herpetic activity of glycyrrhizic acid by physiological proteins. Antivir Chem Chemother 2001;12(2):125-131.