М.В. Павлова, Н.Е. Федорова, З.С. Гаджиева, А.А. Адиева, Ж.В. Евсегнеева, С.Н. Щербо, Е.Г. Гетия, И.Г. Солдатова, М.В. Дегтярева, Н.Н. Володин, Е.Н. Выжлова, В.В. Малиновская, А.А. Кущ
ГУ НИИ вирусологии им. Д.И. Ивановского РАМН;
кафедра неонатологии и кафедра клинической лабораторной диагностики ФУВ ГОУ ВПО РГМУ им. Н.И. Пирогова;
Научно-производственная фирма «Гентех»;
Городская больница No8 Департамента здравоохранения г. Москвы;
ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, Москва
Авторы провели изучение прямых маркеров цитомегаловируса (ЦМВ) и серологических маркеров цитомегаловирусной инфекции (ЦМВИ) в неонатальном периоде и на протяжении первого года жизни у детей, родившихся преждевременнно. Для эффективной диагностики врожденной ЦМВИ у недоношенных новорожденных детей (ННД) следует использовать комплекс методов, включающий выявление специфических антител (АТ) класса IgM, определение авидности анти-ЦМВ-АТ класса IgG, детекцию ДНК ЦМВ методом ПЦР, определение инфекционной активности ЦМВ быстрым культуральным методом. Предпочтительным объектом скринингового исследования является моча, в которой ЦМВ накапливается чаще всего и в больших количествах, чем в других клинических материалах (слюна, кровь, ликвор). Выявление высокоавидных анти-ЦМВ-АТ имеет положительное, а отсутствие анти-ЦМВ-АТ или присутствие низкоавидных АТ к ЦМВ — отрицательное прогностическое значение. ННД с признаками внутриутробной инфекции (ВУИ) необходимо обследовать в динамике на протяжении 1-го года, так как у 30% детей, не имвших на 1-й неделе жизни маркеров ЦМВ, обнаруживаются маркеры ЦМВИ через 1–6 месяцев после рождения. Включение виферона в комплекс базовой терапии ВУИ у ННД оказывает положительное влияние на клинические проявления и исход заболевания. Авторы приводят алгоритм лабораторного обследования и лечения ННД с клиническими признаками ВУИ.
Authors studied direct markers of cytomegalovirus (CMV) and serological markers of cytomegaloviral infection (CMVI) in premature born children in neonatal period and dring first year of life. They recommend to use next complex of methods for effective diagnosis of congenital CMVI in premature born neonates (PBN): detection of specific IgM antibodies (AB); detection of anti-CMV IgG avidity, detection of CMV-DNA by PCR-method, detection of CMV infections activity by cultural method. Urine is most preffered object of screening examination, because CMV accumulates there most often an to a grater extent in comparison with other biological fluids (saliva, blood, liquor). Presence of anti-CMV-AB with high avidity has positive prognostic value; and absence of anti-CMVAB or presence of fnti-CMV-AB with low avidity have negative prognostic value. PBN with signs of intrauterine infections (IUI) must be examined in dynamics during first year of life, since 30% of children with abscence of CMVI markers in 1st week of life demonstrate presence of these markers 1–6 month later. Viferon usage in complex basic therapy of PBN with IUI exert positive influence upon clinical presentations and outcome o dicease. Authors present algorithm of laboratory examination and treatment of PBN with clinical signs of IUI.
Цитомегаловирусная инфекция (ЦМВИ) является одной из самых распространенных врожденных вирусных инфекций. Клинически выраженные формы ЦМВИ могут вызывать тяжелую патологию, вплоть до гибели ребенка [1]. Однако даже при бессимптомных формах у 5–15% детей в ближайшие 1–2 года и в более поздние сроки регистрируются нарушения ЦНС, слуха, зрения, детский церебральный паралич, отставание в умственном развитии, плохая успеваемость в школе [2]. Диагностика ЦМВИ у новорожденных детей (НД) часто представляет сложную задачу в связи с отсутствием дифференцирующих клинических признаков ЦМВИ, а также из-за особенностей иммунной системы НД. Недоношенные новорожденные дети (ННД) представляют группу высокого риска по развитию ЦМВИ [3]. В связи с этим разработка четких рекомендаций по лабораторному обследованию ННД с сочетанной перинатальной патологией и подозрением на ЦМВИ в России остается актуальной задачей. На важность решения данной проблемы указывают также данные о том, что именно ЦМВИ часто служит причиной гибели детей во втором полугодии жизни [4].
Не менее важной проблемой является выбор адекватной терапии ННД с ЦМВИ. С этой целью в настоящее время используют препараты иммуноглобулинов, в том числе обогащенные антителами к ЦМВ [2, 5]. Однако высокая стоимость этих препаратов, их ограниченная доступность и преимущественная направленность их действия на коррекцию гуморальных факторов иммунной защиты [6, 7] ограничивают их применение; при этом имеются убедительные доводы в пользу необходимости дополнительного воздействия на клеточные механизмы врожденного и адаптивного иммунного ответа, в частности, с целью увеличения функциональной активности цитотоксических Т-лимфоцитов, способных элиминировать вирусы и другие внутриклеточные патогены. Одним из перспективных современных подходов к лечению внутриутробных инфекций (ВУИ) является использование препаратов интерферонов (ИФН), среди которых для лечения НД разрешен только Виферон, содержащий рекомбинантный интерферон ?2b человека в комбинации с витаминами С и Е. В связи с этим представляло интерес оценить влияние препарата Виферон на результаты комплексного лечения ВУИ у ННД с низкой массой тела при рождении. Цель настоящего исследования заключалась в определении тактики лабораторного обследования ННД с подозрением на ЦМВИ в течение первого года жизни. Для этого проводили изучение прямых маркеров ЦМВ и серологических маркеров ЦМВИ у детей в неонатальном периоде и на протяжении первого года жизни. Действие Виферона оценивали путем сравнительного анализа клинических проявлений и исходов заболевания при базовом лечении ВУИ и при терапии с включением Виферона.
Материалы и методы исследования
В период с 2006 по 2008 гг. было проведено исследование маркеров ЦМВИ у 174 НД, родившихся в специализированном акушерском отделении Городской больницы No8 Департамента здравоохранения г. Москвы. Обследованные дети были разделены на 4 группы. Основную группу (1-я группа) составили 107 ННД (гестационный возраст — ГВ — от 25 до 36 нед, в среднем 29,8±2,8 нед) с клиническими признаками ВУИ бактериальной или смешанной этиологии, переведенные сразу после рождения в отделение реанимации и интенсивной терапии (ОРИТ). У ННД данной группы наблюдались такие клинические проявления ВУИ, как пневмония — в 92 случаях, энтероколит — в 65 случаях, менингит — в 9 случаях, энцефалит — в 3 случаях, менингоэнцефалит — в 5 случаях, инфекция органов мочевой системы — в 5 случаях, бронхолегочная дисплазия — в 37 случаях. Сочетание двух и более очагов бактериальной инфекции регистрировалось у 57 ННД. Определялись такие симптомы, как ранняя желтуха, увеличение размеров печени и/ или селезенки, геморрагический синдром, судорожный синдром, гидроцефалия, лабораторные симптомы системной воспалительной реакции организма. При микробиологическом исследовании положительные результаты посевов крови на 1-й неделе жизни имели место у 13 пациентов ОРИТ, при этом в 12 случаях высевались грамположительные кокки, в одном случае — грамотрицательные палочки. В группу сравнения (2-я группа) были включены 18 ННД без клинических признаков ВУИ (ГВ от 32 до 37 нед, в среднем 34,6±1,2 нед). Контрольную группу (3-я группа) составили 32 доношенных новорожденных ребенка, родившихся без признаков ВУИ (ГВ 38–41 нед, в среднем 38,9±0,8 нед). Дети из 2-й и 3-й групп находились в детском отделении роддома ГБ No8. Дети, вошедшие в 1-ю, 2-ю и 3-ю группы, были первично обследованы на 1-й неделе жизни. Дополнительную группу (4-я группа) составили 17 детей, поступивших в ДГКБ No13 им. Н.Ф. Филатова Департамента здравоохранения г. Москвы с признаками ВУИ в возрасте 1–3 месяцев, и были первично обследованы на ЦМВИ в этом возрасте.
Все ННД с ВУИ получали базовую комплексную терапию в соответствии со структурой их диагноза и тяжестью состояния. У всех больных детей стандартная комплексная терапия включала антибактериальную терапию, инфузионную и посиндромную терапию, направленные на коррекцию витальных показателей. 45 детей получили инфузию свежезамороженной плазмы М.В. Павлова, Н.Е. Федорова, З.С. Гаджиева и др. по поводу геморрагического синдрома. В связи с развитием анемии 65 пациентов ОРИТ получили трансфузию эритроцитной массы. Всем недоношенным детям с симптомокомплексом ВУИ проводилась иммунозаместительная терапия препаратами иммуноглобулинов для внутривенного введения по общепринятой схеме. Дополнительно к базовой терапии 86 детей с 7–14-х суток жизни получали Виферон ректально по 1 свече, содержащей 150 000 МЕ рекомбинантного интерферона ?2b человека каждые 12 ч в течение 7 дней. Группу сравнения составили 38 детей сходного гестационного и постнатального возраста, получавших стандартную комплексную терапию по поводу ВУИ в ОРИТ.
Быстрый культуральный метод (БКМ) выполняли в соответствии с Методическими рекомендациями, утвержденными Роспотребнадзором [8]. В качестве клинических материалов использовали периферическую кровь, мочу и слюну, по показаниям — ликвор. В культуру диплоидных фибробластов эмбриона человека (ФЭЧ) вносили клинический материал и инкубировали в течение 1 ч при температуре 37°С в атмосфере 5% СО2. Затем клетки отмывали, продолжали культивировать и через 48 ч фиксировали. Детекцию ЦМВ проводили с помощью моноклональных антител (МКА) к белкам ЦМВ в реакции непрямой иммунофлюоресценции [9].
Определение IgM- и IgG- антител (АТ) к ЦМВ в сыворотке крови проводили методом твердофазного иммуноферментного анализа (тИФА), используя коммерческие наборы фирмы «Диагностические системы» (Россия). Для выявления АТ класса IgM использовали тест-систему «ДС-ИФА-АНТИ-ЦМВ-M CM-153», для выявления АТ класса IgG — «ДС-ИФА-АНТИ-ЦМВ-G CM-151». Анализ и интерпретацию результатов осуществляли в соответствии с инструкциями фирмы-производителя.
Индекс авидности (ИА) специфических IgG определяли с помощью тест-системы фирмы «Диагностические системы» («ДС-ИФА-АНТИ-ЦМВ-G Авидность СМ-152», Россия). Оценку результатов осуществляли согласно рекомендациям фирмы-производителя. Определение ДНК ЦМВ в клинических образцах методом полимеразной цепной реакции (ПЦР) проводили в лаборатории «Диасан» (Москва). В работе были использованы набор реагентов для выявления нуклеотидных последовательностей (cytomegalovirus) методом ПЦР «ЦМВ Ам» научно-производственной фирмы «Гентех» (Москва), согласно инструкции фирмы производителя. Чувствительность определения ДНК ЦМВ составляла 103 молекул вирусной ДНК в 1 мл.
Статистическую обработку результатов проводили с использованием пакета прикладных компьютерных программ STATISTICA 6,0. Частоту встречаемости маркеров ЦМВ анализировали с помощью критерия ?2.
Таблица 1
Сравнение частоты выявления ЦМВ в клинических образцах методом ПЦР и БКМ
| Кол-во образцов | Совпадение | Несовпадение | ||||
| БКМ+ ПЦР+ |
БКМ– ПЦР– |
Итого | БКМ+ ПЦР– |
БКМ– ПЦР+ |
Итого | |
| n=569 | 36 (6,3%) |
484 (85,1%) |
520 (91,4%) |
10 (1,8%) |
39 (6,8%) |
49 (8,6%) |
Различия считали статистически значимыми при р
Результаты и их обсуждение
Исследованы 569 клинических образцов: мочи — 235, крови — 195, слюны — 78 и ликвора — 61. В каждом образце параллельно выявляли ДНК ЦМВ методом ПЦР и инфекционную активность ЦМВ с помощью количественного варианта БКМ.
В результате анализа всех полученных образцов от детей всех групп было показано, что чаще всего инфекционная активность ЦМВ выявлялась в моче — в 34/235 (14,5%) проб, реже в слюне — в 8/78 (10,3%) проб. В крови и ликворе вирус встречался редко — с частотой 1% (2/195) и 3,3% (2/61) соответственно. ДНК ЦМВ также чаще обнаруживалась в моче (18,7%) и в крови (13,3%). Частота выявления ДНК вируса в слюне составила 11,5%, в ликворе — 8,2%. Эти данные согласуются с результатами других исследователей, которые показали, что в моче ЦМВ обнаруживается в количествах в 180 раз больших, чем в крови [10]. На основании этих данных диагностика внутриутробной ЦМВИ в медицинских центрах европейских стран проводится путем изучения мочи БКМ. В целом следует отметить, что геном вируса в образцах встречался чаще, чем инфекционная активность ЦМВ: всего положительных образцов методом БКМ было выявлено 46 из 569 (8,1%), методом ПЦР — 75 (13,2%) (p=0,0052).
Таблица 2
Выявление прямых маркеров ЦМВ у новорожденных детей
| Группы детей | ДНК ЦМВ (ПЦР) |
Инфекционная активность ЦМВ (БКМ) |
| 1-я (основная) | 15,9% (17/107) | 16,8% (18/107) |
| 2-я (сравнения) | 5,6% (1/18) | 0% (0/18) |
| 3-я (контрольная) | 6,3% (2/32) | 0% (0/32) |
| 4-я (дополнительная) | 47,1% (8/17) | 29,4% (5/17) |
Сравнительные данные определения ЦМВ методом БКМ и ПЦР представлены в табл. 1. При исследовании подавляющего большинства образцов (91,4%) наблюдалось совпадение данных, причем в основном наблюдалось совпадение отрицательных результатов, полученных двумя методами. Положительные результаты совпали при анализе 36 образцов, не совпали при исследовании 49 образцов из 569 изученных. В 39 случаях при отрицательном результате БКМ была выявлена ДНК ЦМВ, в 10 образцах при наличии инфекционно активного вируса результат ПЦР был отрицательным.
Следующая задача состояла в оценке частоты выявления ЦМВ у детей на 1-й неделе жизни. Ребенка рассматривали как инфицированного, если ЦМВ был обнаружен, по крайней мере, в одном из полученных от него образцов клинического материала. Инфекционная активность ЦМВ методом БКМ была выявлена у 16,8% детей 1-й группы (18/107), тогда как во 2-й и 3-й группах вирус не был выявлен ни у одного из обследованных детей (табл. 2). В 4-й группе этот показатель при первичном обследовании в возрасте 1–3 месяцев составил 29,4% (5/17). Методом ПЦР ДНК ЦМВ была обнаружена у 15,9% детей 1-й группы (17/107), у 5,6% (1/18) детей 2-й группы сравнения, у 6,3% (2/32) доношенных детей без ВУИ 3-й группы и у 47,1% детей (8/17) 4-й группы. С помощью двух методов в 1-й группе на 1-й неделе жизни у 28/107 ННД (26,2%) в клинических образцах методом ПЦР и/ или БКМ были выявлены прямые маркеры ЦМВ. При первичном обследовании детей в возрасте 1–3 месяцев (4-я группа) этот показатель был значительно выше и составил 47,1%. Полученные данные показали, что использование двух лабораторных методов (БКМ и ПЦР) существенно повышает эффективность диагностики ЦМВИ. Так, при обследовании детей на 1-й неделе жизни ЦМВ был обнаружен методом ПЦР у 17 детей, БКМ — у 18 детей, тогда как двумя методами — у 28 детей. Обнаружение ЦМВ прямыми лабораторными методами у ребенка в течение первых 3 недель жизни свидетельствует о внутриутробной передаче вируса от матери к ребенку [11]. Таким образом, можно утверждать, что у 26,2% ННД с клиническими признаками ВУИ была выявлена внутриутробная ЦМВИ. Выделение вируса после 3-й недели жизни ребенка может отражать как врожденную, так и постнатальную инфекцию [12]. Следовательно, у 8 детей из 4-й группы инфицирование могло произойти как внутриутробно, так и после рождения.
Расхождения данных ПЦР и БКМ могут быть следствием двух обстоятельств: более высокой чувствительности ПЦР и/или более высокой прогностической значимости БКМ [13]. Так, при анализе данных ПЦР и БКМ во 2-й и 3-й группах по сравнению с 1-й и 4-й группами (табл. 2) обнаружение ДНК ЦМВ не сопровождалось проявлением инфекционной активности вируса, и именно во 2-й и 3-й группах у детей отсутствовали клинические симптомы ВУИ.
Таблица 3
Результаты обследования новорожденных детей с помощью серологических методов
| Группы детей | Выявление анти- ЦМВ-IgM-АТ |
Отсутствие анти- ЦМВ-IgG-АТ |
Авидность анти-ЦМВ-IgG-АТ (ИА) | |
| > 0,6 | ||||
| 1-я (основная) | 1,1% (1/93) |
9,7% (9/93) |
38,6% (32/83*) |
61,4% (51/83*) |
| 2-я (сравнения) | 0% (0/18) |
16,7% (3/18) |
33,3% (5/15*) |
66,7% (10/15*) |
| 3-я (контрольная) 0% (0/32) |
9,4% (3/32) |
13,8% (4/29*) |
86,2% (25/29*) |
|
| 4-я (дополнительная) | 23,5% (4/17**) |
5,9% (1/17) |
13,3% (2/15*) |
66,7% (10/15*) |
* авидность IgG определяли только у детей, в сыворотках крови которых были выявлены АТ к ЦМВ класса IgG;
** у 3/4 детей, в сыворотках крови которых были обнаружены наряду с анти-ЦМВ класса IgМ, также и антиЦМВ класса IgG.
Полученные данные могут иметь важное значение при принятии решения о начале специфической противовирусной анти-ЦМВ терапии и при мониторинге лечения.
Представляло интерес сравнить инфекционную активность ЦМВ в изученных пробах. Согласно проведенному анализу БКМ, у детей 1-й группы в большинстве образцов (94,4%) была выявлена низкая инфекционная активность, соответствующая 5–15 вирусным частицам в 1 мл клинического материала, и лишь в одном образце мочи (5,6%) было обнаружено 70 000 вирусных частиц в том же объеме пробы. Интересно, что у детей 4-й группы во всех положительных пробах была выявлена высокая инфекционная активность ЦМВ (от 500 до 7500 вирусных частиц в 1 мл пробы).
Для изучения показателей специфического гуморального иммунитета у НД были использованы два серологических теста: выявления анти-ЦМВАТ и определение ИА специфических АТ с помощью ИФА. Полученные данные представлены в табл. 3. В периферической крови у подавляющегося большинства детей присутствовали АТ к ЦМВ класса IgG. Анти-ЦМВ-IgG отсутствовали у 9 из 93 новорожденных (9,7%) 1-й группы. Образцы крови 14 ННД серологическими методами анализа исследованы не были. У одного ребенка 1-й группы на 1-й неделе жизни были идентифицированы также маркеры острого инфекционного процесса — анти-ЦМВ-IgM (табл. 3). Невысокая частота выявления анти-ЦМВ-АТ класса IgМ у НД отмечалась также другими авторами [14]. Напротив, в 4-й группе (возраст 1–3 месяца) показатель частоты выявления анти-ЦМВ-IgM был высок и составил 23,5% (табл. 3). Важно отметить, что у всех детей с анти-ЦМВ-IgM отсутствали анти-ЦМВ-АТ класса IgG и были выявлены прямые маркеры ЦМВ. Оценка авидности IgG-АТ показала, что среди ННД с ВУИ у 32 из 83 (38,6%) детей ИА был представлен низким или промежуточным значением (ИА0,6) (табл. 3).
Показано, что у 65,4% детей с ВУИ, в крови которых АТ класса IgG отсутствовали, либо обладали ИА0,6. Высокоавидные АТ наблюдались в 86,2% случаев (табл. 3). Из 107 ННД 1-й группы, первично обследованных на 1-й неделе жизни, клинические материалы 26 детей были изучены в динамике трижды. Повторные обследования проводили через 1–3 и 5–7 месяцев после рождения. Результаты обследования ННД с признаками ВУИ в динамике представлены в табл. 4. На 1-й неделе жизни прямые маркеры ЦМВ (положительный анализ БКМ и/или ПЦР) были обнаружены у 9 из 26 детей (34%). При выявлении инфекционной активности ЦМВ методом БКМ вирусная нагрузка составляла 10–15 инфекционных частиц в 1 мл клинического материала.
Таблица 4 Динамика выявление прямых маркеров ЦМВ у 26 ННД с признаками ВУИ
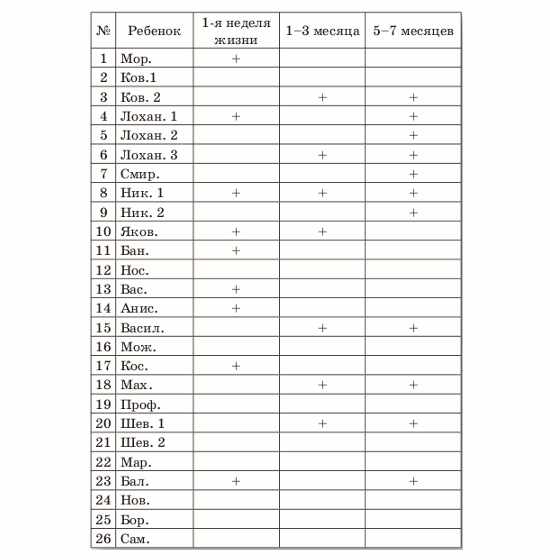
Пустые ячейки означают отсутствие прямых маркеров ЦМВИ.
При повторном обследовании детей через 1–3 месяца после рождения у 7 из 9 (77,7%) первично инфицированных детей вирус обнаружен не был, у 2 детей ЦМВ был выявлен повторно. Можно предположить, что элиминация вируса у ННД с внутриутробной ЦМВИ явилась результатом проведения комплексной этиотропной, посиндромной и иммуномодулирующей терапии Вифероном в отделениях реанимации новорожденных. Возможно, элиминация ЦМВ является также результатом сочетанного действия терапии и активации собственного гуморального и клеточного антивирусного ответа у повторно обследованных детей. Важно отметить, что у 5 из 26 (19,2%) детей, отрицательных по ПЦР и БКМ на 1-й неделе жизни, через 1–3 месяца после рождения ЦМВ был обнаружен впервые. Интересным является тот факт, что у 3 из 5 детей, у которых была выявлена инфекционная активность ЦМВ методом БКМ в это время, была обнаружена высокая вирусная нагрузка, которая варьировала от 1000 до 200 000 инфекционных частиц в 1 мл пробы. У 2 из 5 детей была обнаружена только ДНК ЦМВ. Возможно, выявление ЦМВ у части детей через 1–3 месяца является отсроченным проявлением внутриутробной бессимптомной ЦМВИ. Не исключено также, что инфицирование этих новорожденных ЦМВ произошло уже в неонатальном периоде, в частности, при гемотрансфузиях или при вскармливании младенцев инфицированным грудным молоком. Такие дети нуждаются в дальнейшем обследовании, поскольку ЦМВИ часто выявляется, а иногда и служит причиной гибели детей во втором полугодии жизни [4]. Всего в возрасте 1-3 месяцев у 7 из 26 детей были выявлены прямые маркеры ЦМВИ (27%). Интересно отметить, что данный по- казатель был близок к частоте выявления прямых маркеров вируса у детей с ВУИ 4-й группы при их первичном обследовании, когда они находились в таком же возрасте (табл. 2).
Через 5–7 месяцев после рождения у одного из 7 детей (14,3%), у которых в возрасте 1–3 месяцев выявлялись прямые маркеры ЦМВИ, вирус эли- минировался. У остальных 6 детей (85,7%) ЦМВ продолжал определяться. Важно отметить, что в эти сроки еще у 3 детей (11,5%) с ВУИ при рож- дении впервые появились прямые маркеры ЦМВ. В целом на 5–7-м месяце жизни у 9 из 26 детей присутствовал ЦМВ (34,6%).
Из групп доношенных и недоношенных НД без ВУИ повторно были обследованы 15 детей через 7–12 месяцев после рождения. У одного ребенка в моче спустя 8 месяцев после первичного обсле- дования был обнаружен инфекционно активный вирус (5000 вирусных частиц в 1 мл). ДНК ЦМВ была выявлена у 5 из 15 детей (33,3%), однако сравнительная оценка показала, что количество ДНК ЦМВ в пробах было низким.
Таким образом, на 1-м году жизни из 26 обсле- дованных в динамике ННД с клиническими при- знаками ВУИ у 17 детей (65,4%) в различные сро- ки были выявлены прямые маркеры ЦМВИ. Это согласуется с результатами других исследований [3], подтверждающими высокий риск развития ЦМВИ у этой группы НД.
Cравнительное изучение одновременно сероло- гических показателей и вирусных маркеров в дина- мике было проведено у 75 ННД с ВУИ из 1-й группы
Таблица 5
Сравнение показателей летальности у детей с ВУИ, получавших и не получавших терапию Вифероном.
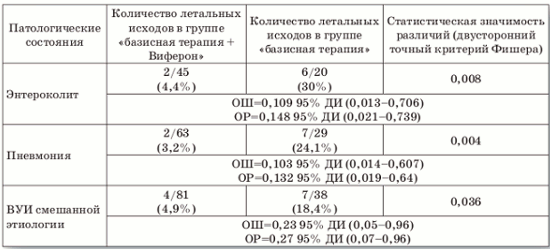
Рисунок. Динамика выявления серологических маркеров ЦМВИ у недоношенных новорожденных детей.
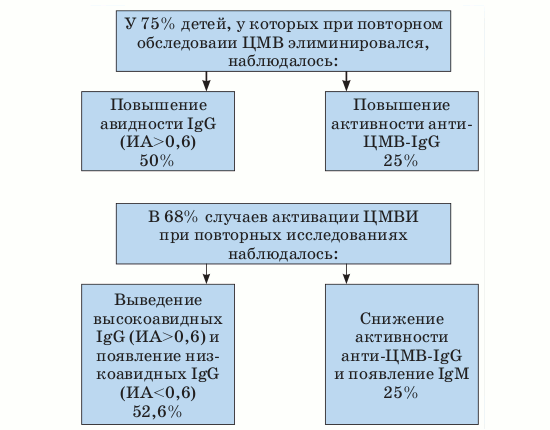
В течение 1-го года жизни наблюдалась корреляция обнаружения/элиминации ЦМВ с серологическими показателями (см. рисунок). Так, у 21/75 детей 1-й группы через 1–6 месяцев после рождения в материалах были впервые выявлены прямые маркеры ЦМВИ. В периферической крови 13 из этих 19 детей (2 ребенка не были обследованы) в 68,4% случаев при повторных исследованиях происходило либо выведение высокоавидных, по всей видимости, материнских IgG-АТ и появление собственных низкоавидных IgG-АТ с ИА Суммируя полученные данные, можно заключить следующее:
• для повышения эффективности диагностики врожденной ЦМВИ и прогноза ее развития у ННД с ВУИ необходимо использовать комплекс методов, включающий выявление противовирусных АТ, в том числе класса IgM; определение авидности анти-ЦМВ-АТ класса IgG; детекцию ДНК ЦМВ методом ПЦР; определение инфекционной активности ЦМВ методом БКМ;
• предпочтительным объектом скринингового исследования для диагностики внутриутробной ЦМВИ является моча, в которой вирус накапливается чаще всего и в бо=льших количествах, чем в других клинических материалах;
• выявление высокоавидных анти-ЦМВ-АТ имеет положительное прогностическое значение, так как у большинства обследованных детей в динамике оно сопровождалось элиминацией прямых маркеров ЦМВ. Напротив, отсутствие анти-ЦМВАТ или присутствие низкоавидных АТ к ЦМВ имеют отрицательное прогностическое значение, так как ассоциируются c появлением маркеров ЦМВ через 1–6 месяцев после рождения;
• ННД с ВУИ необходимо обследовать в динамике, по крайней мере, в течение 1-го года жизни, так как у 30,8% (8/26) детей, у которых на 1-й неделе жизни не были обнаружены маркеры вируса, они были выявлены через 1–6 месяцев после рождения;
• иммуномодулирующий препарат Виферон, содержащий рекомбинантный интерферон ?2b человека в сочетании с витаминами С и Е, при ректальном введении оказывает положительное действие на клинические проявления и исход заболевания, о чем свидетельствует статистически значимое снижение показателя летальности у ННД с ВУИ по сравнению с группой детей, получавших базовое лечение без Виферона.
С учетом вышеизложенного, предлагается следующий алгоритм лабораторного обследования и лечения ННД с клиническими признаками ВУИ:
• анализ мочи на 1-й неделе жизни (до 3 недель жизни) методом БКМ для выявления внутриутробной ЦМВИ;
• исследование клинических материалов в динамике через 1, 3 и 6–7 месяцев после рождения для установления возможной реактивации ЦМВ и развития ЦМВИ у ННД с ВУИ;
• при обнаружении ЦМВ в клинических материалах БКМ в количествах, превышающих по инфекционной активности 5–10 вирусных частиц в 1 мл, оценивать необходимость использования терапевтических средств;
• включать иммуномодулирующий препарат Виферон в комплексное лечение ННД с клиниколабораторными признаками ВУИ.
ЛИТЕРАТУРА
1. Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev. Med. Virol. 2007; 17 (4): 253–276.
2. Michaels MG. Treatment of congenital cytomegalovirus: where are we now? Expert. Rev. Anti. Infect. Ther. 2007; 5 (3): 441–448.
3. Yamamoto AY, Mussi-Pinhata MM, Cristina P et al. Congenital cytomegalovirus infection in preterm and full-term newborn infants from a population with a high seroprevalence rate. Pediatr. Infect. Dis. J. 2001; 20 (2): 188–192.
4. Нисевич Л.Л., Каск Л.Н., Адиева А.А., Кущ А.А. Перинатальные факторы риска инфицирования плода, патологии и смерти в перинатальном и младенческом возрасте. Вопр. акушерства, гинекологии и перинаталогии. 2007; 6 (4): 13–17.
5. Hamprecht K, Jahn G. Human cytomegalovirus and congenital virus infection. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2007; 50 (11): 1379–1392.
6. Ruiz JE, Kwak JY, Baum L et al. Intravenous immunoglobulin inhibits natural killer cell activity in vivo in women with recurrent spontaneous abortion. Am. J. Reprod. Immunol. 1996; 35 (4): 370–375.
7. Denys C, Toungouz M, Dupont E. Increased in vitro immunosuppressive action of anti-CMV and anti-HBs intravenous immunoglobulins due to higher amounts of interferon-gamma specific neutralizing antibodies. Vox Sang. 1997; 72 (4): 247–250.
8. Быстрый культуральный метод диагностики герпесвирусных инфекций. Методические рекомендации No 02.030-08. М.: Роспотребнадзор, 2008: 20.
9. Макарова Н.Е., Кущ А.А., Иванова Л.А. и др. Получение моноклональных антител к сверхранним белкам цитомегаловируса человека и их применение для выявления инфицированных клеток. Вопр. вирусол. 1996; 41 (1): 28–32.
10. Halwachs-Baumann G, Genser B, Pailer S et al. Human cytomegalovirus load in various body fluids of congenital infected newborns. J. Clin. Virol. 2002; 25: 81–87.
11. Lazzarotto T, Guerra B, Lanari M et al. New advances in the diagnosis of congenital cytomegalovirus infection. J. Clin. Virol. 2008; 41 (3): 192–197.
12. Graza A, Silverio C, Ferreira JP et al. Congenital or neonatal cytomegalovirus infection? Acta Med. Port. 2004; 17 (4): 335–340.
13. Воронцова Ю.Н., Володин Н.Н., Дегтярев Д.Н. и др. Особенности клинических проявлений врожденной цитомегаловирусной инфекции у недоношенных новорожденных. Рос. вестн. перинатологии и педиатрии. 2004; 49 (2): 60–66.
14. Nelson CT, Demmler GJ. Cytomegalovirus infection in the pregnant mother, fetus and newborn infant. Clin. Perinatol. 1997; 24: 151–160.
15. Karen B. Fowler, Robert F et al. Risk Factors for Congenital Cytomegalovirus Infection in the Offspring of Young Women: Exposure to Young Children and Recent Onset of Sexual Activity. Pediatrics. 2006; 118: 286–292.
Педиатрия/2009/Том 87/No2




