Клинические исследования
 Какими исследованиями подтверждена безопасность препарата ВИФЕРОН?
Какими исследованиями подтверждена безопасность препарата ВИФЕРОН?
Препарат ВИФЕРОН прошел полный цикл доклинических и клинических исследований в соответствии с требованиями законодательства Российской Федерации, включая многоцентровые двойные слепые плацебо-контролируемые исследования.
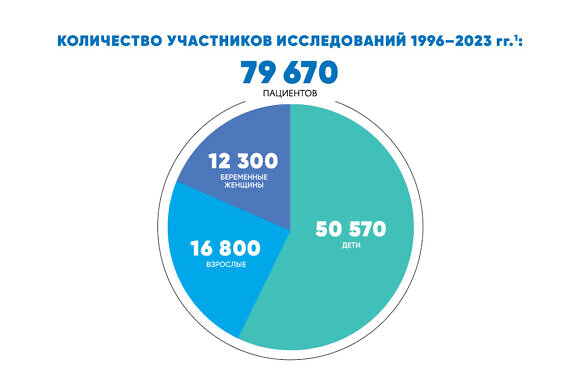
В период с 1996 по настоящее время в исследованиях приняло участие более 79 000 пациентов, в том числе 50 570 детей, включая новорожденных, и 12 300 беременных женщин[1].
Проведено 17 полномасштабных клинических исследований на базе 64 ведущих научно-исследовательских центров (медицинские учреждения) Российской Федерации. В настоящее время в стадии реализации находятся 5 клинических исследований с применением препарата ВИФЕРОН в различных нозологических областях (расширение показаний к применению препарата).
На основании проведенных исследований препарата ВИФЕРОН, при лечении различных заболеваний: ОРВИ, включая COVID-19 и грипп, в том числе осложненные пневмонией, хронический бактериальный простатит, герпесвирусные инфекции, вирусные менингиты, папилломавирусная инфекция и урогенитальные инфекции, хронические вирусные гепатиты у детей (включая новорожденных) и взрослых (включая беременных и кормящих женщин) были опубликованы многочисленные статьи в авторитетных изданиях, которые цитируются в международных научных библиотеках (Pubmed, Cochrane Library) и на самом крупном электронном медицинском ресурсе России: E-library, где представлены более 4000 источников с упоминанием препарата ВИФЕРОН. Более 175 статей о препарате представлены в единой библиографической и реферативной базе данных рецензируемой научной литературы Scopus.
Клинические исследования
Клинические исследования препарата ВИФЕРОН, проводимые с 1996 и по настоящее время, (в том числе рандомизированные двойные слепые плацебо-контролируемые исследования) подтвердили высокую эффективность и хорошую переносимость препарата у детей, в т.ч. новорожденных и недоношенных, и взрослых, включая беременных женщин.
Препарат ВИФЕРОН входит в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утверждённый распоряжением Правительства Российской Федерации[2].
Препарат ВИФЕРОН представляет собой фиксированную комбинацию ранее изученных веществ, входящих в состав широко применяющихся в качестве лекарственных препаратов у детей и взрослых.
Далее приведены результаты основных клинических исследований: Клинические исследования. Подробнее…
Пострегистрационные испытания
Помимо представленных исследований, компания ООО «ФЕРОН» проводит более 10 крупных научно-исследовательских работ в крупнейших научных и медицинских центрах России и СНГ, целью которых является изучение эффективности и безопасности препарата ВИФЕРОН при лечении различных актуальных заболеваний.
Доклинические исследования
Препарат ВИФЕРОН прошел полный цикл доклинических исследований с использованием половозрелых и неполовозрелых животных.
Результаты исследований показали, что препарат нетоксичен как в остром, так и в хроническом эксперименте. ВИФЕРОН относится к низкотоксичным препаратам (не обладает репротоксичностью, эмибриотоксичностью, иммунотоксичностью и аллергизирующим сенсибилизирующим действием). Это значит, что применение препарата не влияет на состояние и течение беременности у животных, а также не оказывает влияние на физическое развитие плода.
При изучении отдельных видов токсичности было показано, что ВИФЕРОН не обладает влиянием на физическое развитие, скорость созревания сенсорно-двигательных рефлексов, эмоционально-двигательное поведение, тонкую координацию движений, а также обучаемость и память потомства в постнатальном периоде жизни. Так же установлено отсутствие влияния на репродуктивную функцию у потомства крыс, получавших интерферон альфа-2b.
Проведённые доклинические исследования показали отсутствие тератогенного эффекта у крыс и кроликов, и более того применение препарата в дозе, превышающей в 120 раз условную терапевтическую, в течение 30 дней не оказывает токсического действия на организм подопытных животных, в том числе и неполовозрелых. Установлено, что длительное введение препарата — 30 дней и более не оказывает местно-раздражающего действия.
Автор статьи
Врач общей практики, к.м.н.
[1] По данным проведенных двойных слепых многоцентровых плацебо-контролируемых клинических исследований, а также когортных, проспективных, сравнительных, интервенционных и неинтервеционных научных исследований, проведенных с 1996 по 2023 г. в ведущих научно-исследовательских институтах и медицинских учреждениях России, таких как: ФГБУ НИИ «Гриппа», ФГУ НИИ «Детских инфекций», ФГУ «НИИ Вирусологии им. Д.И. Ивановского», ФГБУ «НИЦЭМ» им. Н.Ф. Гамалеи МЗ РФ, ФГБОУ ДПО «РМАНПО» МЗ РФ, ГБОУ ВПО «Санкт-Петербургская государственная педиатрическая медицинская академия» МЗ РФ, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», ГУЗ «МОНИИАГ», ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» МЗ РФ, ГБОУ ВПО «Ростовский государственный медицинский университет» МЗ РФ и других.
[2] МНН интерферон альфа-2b. Распоряжение Правительства РФ от 12.10.2019 №2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи».
