Л.А. Литяева, д.м.н., профессор, зав. кафедрой детских инфекций,
М.В. Локун, врач-детский гинеколог Оренбургская государственная медицинская академия
TERRA MEDICA NOVA №2/2006; СТР.30-33
В настоящее время наблюдается увеличение частоты, тяжести и длительности течения воспалительных заболеваний влагалища у девочек (1,2). Это во многом связано с увеличением контингента девочек с микроэкологическими и иммунными нарушениями и обусловленного этим снижением уровня колонизационной резистентности микроэкологической системы.
Микроэкологическая система макроорганизма – едина и входящие в нее экосистемы кожи, дыхательных путей, пищеварительной, мочевыводящей и половой систем находятся во взаимодействии и в тоже время в соподчинении с главным звеном этой системы микробиоценозом желудочно-кишечного тракта.
Микроэкологическая система пищеварительного тракта, являясь открытым биоценозом, осуществляет постоянную циркуляцию микроорганизмов между микрофлорой окружающей среды и желудочно-кишечного тракта и выступает в качестве биосорбента.
Дисбиотический процесс желудочно-кишечного тракта приводит к агрессии условно-патогенных и патогенных микроорганизмов с последующим развитием клинико-морфологических декомпенсаций, что негативно воздействует на состояние микробиоценозов и функционирование других экосистем.
В момент рождения происходит быстрая колонизация кишечника ребенка бактериями, входящими в состав интестинальной и вагинальной флоры матери. Они же определяют первичную колонизацию биоценоза влагалища девочек, спектр которого сохраняет относительную устойчивость первые три года и более (3).
Микроэкологический дисбаланс влагалища у девочек зависит от многих факторов. Прежде всего, от наличия у матерей инфекционно-воспалительных заболеваний урогенитального тракта, микроэкологических нарушений родовых путей и связанного с этим нарушений становления и недостаточности лактации, а также формирования микробиоценоза желудочно-кишечного тракта ребенка. Из других факторов следует отметить перенесенные девочками инфекции кишечника и мочевых путей, частые ОРВИ, дискинезии кишечника и желчевыводящих путей, болезни печени и поджелудочной железы.
Возникновению вульвовагинитов у девочек в немалой степени способствуют анатомо-физиологические особенности полового аппарата: тонкая легкоранимая кожа, покрывающая область наружных гениталий; выраженная складчатость слизистой оболочки влагалища и наличие большого количества вестибулярных желез; щелочная среда влагалищного содержимого; малое содержание гликогена; отсутствие палочек Дедерлейна; слабая эстрогенная насыщенность; низкая иммунная устойчивость.

Клинический опыт убедительно показывает, что в последние годы возрастной состав девочек с воспалительными заболеваниями наружных гениталий претерпел изменения. При сохраняющемся превалировании заболеваемости девочек 4-7 лет (из-за значительного снижения защитных свойств полового канала в этом возрасте) наметилась тенденция роста числа случаев неспецифического вульвовагинита у девочек раннего возраста. Это можно объяснить увеличением контингента новорожденных со сниженными адаптационными возможностями и повышенным риском развития у них инфекционно-воспалительных заболеваний в результате избыточной первичной микробной колонизации условно-патогенными бактериями и замедленной их редукцией.
Результаты наших наблюдений 150 девочек первых 10 лет жизни с неспецифическими вульвовагинитами согласуются с этими данными. Так, частота неспецифического вульвовагинит в периоде раннего детства составила 22,2%, периоде первого детства — 57,8%, периоде школьного возраста — 20% (рис.).
Следует отметить, что практически у всех девочек раннего возраста с неспецифическим вульвовагинитом наблюдались клинические проявления дисфункции кишечника в виде дискинезии по гипомоторному (34,4%) и гипермоторному (43,3%) типам, обусловленные микроэкологическими нарушениями кишечника. Эти изменения, ставшие причиной обращения к врачу, предшествовали поражению гениталий, а у более половины девочек (56%) функциональные нарушения кишечника регистроровались уже в первый месяц жизни.
У большинства девочек были выявлены нарушения толстой кишки (86%). У них на фоне дефицита бифидобактерий (86%), лактобактерий (70%), типичных кишечных палочек (39%) превалировали аэробные грамположительные и грамотрицательные условно-патогенные бактерии (73%) и полимикробные ассоциации (49%).
С профилактической целью все девочки были осмотрены и обследованы детским гинекологом. Клинические проявления воспалительного процесса наружных половых органов у большинства девочек первых трех лет жизни (93%) отсутствовали и только у 7% из них отмечались выделения различной интенсивности, беспокойство при мочеиспускании. У 8% — обнаружены синехии малых половых губ.
Обращает внимание, что почти у половины девочек (45%) без клинических проявлений вульвовагинита были обнаружены изменения влагалищного мазка в виде переходного типа и микроценоза влагалища, свидетельствующие о состоянии предболезни. Это позволило отнести их в группу высокого риска по развитию инфекционно-воспалительных заболеваний наружных гениталий, и нуждающихся в проведении превентивной коррекции.
Дисбиотические изменения микроценоза влагалища были обнаружены у большинства девочек (72%) и характеризовались преобладанием различных видов условно-патогенных бактерий, представленных преимущественно аэробными грамотрицательными бактериями (кишечные палочки, протеи, клебсиеллы) у 59%, кокковой флорой (золотистые стафилококки, зеленящие стрептококки, гемолитические стрептококки, энтерококки, пневмококки) у 31%, полимикробными 2-3 компонентными ассоциациями условно-патогенных бактерий у 70%. Кроме того, были выделены коринобактерии у 3%, грибы рода Candida у 7%.
У девочек 4-10 лет заболевание имело типичные клинико-лабораторные признаки вульвовагинита (воспалительный тип мазка, нарушение микроценоза влагалища), сопровождаемые, как и у девочек раннего возраста, микроэкологическими и функциональными нарушениями кишечника. Последние проявлялись дискинезиями кишечника с поражением верхних его отделов (гастродуоденопанкреатической зоны) и дискинезиями желчевыводящих путей.
Согласно полученным данным нарушения микроэкологии кишечника у девочек не только предшествуют микроэкологическому дисбалансу влагалища, но и играют значительную роль в его формировании и развитии воспалительных процессов наружных гениталий. В связи с этим, мы считаем необходимым проведение регуляции микроэкологических нарушений влагалища у этого контингента девочек одновременно с таковыми в кишечнике.

Наиболее физиологичным по регулирующему влиянию на микрофлору является использование живых культур микроорганизмов (пробиотиков).
Пробиотики – живые микроорганизмы: молочно кислые бактерии, чаще бифидо- и лактобактерии, которые, как следует из термина «пробиотик», относятся к нормальным обитателям кишечника и генеративной системы здорового макроорганизма. Они свободны от побочного действия химических соединений.
Главным представителем индигенной «протективной» микрофлоры урогенитального тракта наряду с лактобактериями являются бифидобактерии. Именно популяция этих бактерий является индикатором дисбиотических сдвигов в данной микроэкологической системе (4,5).
В связи с этим для коррекции микроэкологических нарушений влагалища и кишечника нами использовался комплекс лакто- (ацилакт, лактобактерин) и бифидосодержащих (бифидумбактерин, бифидумбактерин-форте, бифилиз) пробиотиков и иммуномодулятор (виферон).
Выбор коррекционных средств (поликомпонентные, комбинированные, монокомпонентные), их дозировка, продолжительность курса и их количество были индивидуальными и зависели от степени выраженности клинико-микроэкологических изменений генеративной и пищеварительной систем. При значительных нарушениях назначались поликомпонентный лактосодержащий пробиотик ацилакт в свечах интравагинально (до 1 года по 1 дозе 2 раза в день, 2-3 лет — по 2-3 дозы 2 раза в день, старше 3 лет — по 5 доз 2 раза в день) в сочетании с комбинированным бифидосодержащим пробиотиком бифидумбактерин-форте или бифилизом перорально (до 1 года – 15 доз, старше 1 года — 20 доз в сутки, в 2 приема за 30 минут до еды), в течение 21-28 дней. При незначительных дисбиотических нарушениях, а также девочкам группы высокого риска по инфекционно-воспалительным заболеваниям гениталий использовались монокомпонентные пробиотики: лактобактерин интравагинально (до 1 года по 1-2 дозам 2 раза в день, 2-3 лет – по 3-4 дозы 2 раза в день, старше 3 лет – по 5 доз 2 раза в день) и бифидумбактерин перорально (до 1 года 5 доз 2 раза в день, старше 1 года 5-10 доз 2 раза в день) длительностью курса 14-21 день при незначительных нарушениях и 7-14 дней на доклиническом этапе (таблица).
Учитывая, что неспецифические вульвовагиниты изначально возникают на фоне снижения иммунитета слизистых для предупреждения рецидивов заболевания, комплекс бифидо- и лактосодержащих пробиотиков был дополнен иммуномодулятором вифероном (имеющим в своем составе рекомбенантный интерферон-А2 и мембраностабилизирующие компоненты), оказывающим противовирусное, иммуномоделирующее и антипролиферативное действие. В связи с чем, виферон способствует более быстрому и стойкому восстановлению анаэробной флоры при дисбиотических состояниях (6). Виферон назначался ректально в дозе 150000 МЕ 2 раза в сутки в течение 10 дней.
Необходимо отметить, что коррекции дисбиотических нарушений иммунобиопрепаратами предшествовала противовоспалительная терапия наружных гениталий с использованием отваров трав, антисептиков, препаратов, улучшающих процессы репарации, адаптогенов, а также физиотерапевтические процедуры. Антибактериальные препараты назначались местно (в виде свечей, мазевых аппликаций) только в случаях упорного длительного рецидивирующего процесса.
Коррекция дисбиотических нарушений кишечника была также комплексной с использованием пребиотиков, продуктов функционального питания, энтеросорбентов, ферментов, витаминов, желчегонных средств. Антибиотики для деконтаминации применялись только в случаях распространения дисбиотического процесса в верхние отделы кишечника (синдром контаминации тонкой кишки) перорально.
Позитивные результаты комплексной реабилитации девочек с неспецифическими вульвовагинитами были достигнуты у 88,8% из них. У части пациенток (12,2%) — после двух курсов коррекции. У них исчезли зуд, болезненные ощущения в проекции наружных половых органов, нарушение мочеиспускания, улучшилось общее состояние. При гинекологическом осмотре значительно уменьшились патологические выделения, исчезла гиперемия вульвы. К тому же у большинства девочек (87%) отмечалась нормализация характера и частоты стула, улучшился аппетит, исчезли боли в животе, метеоризм.
Исследования микробиоценозов влагалища и кишечника выявили у них позитивные сдвиги показателей нормоценоза обоих биотопов, выражающиеся в снижении концентрации условно-патогенных бактерий и увеличения количественного уровня бифидо- и лактобактерий до популяционного уровня во влагалище (79%) и кишечнике (68%).
Превентивная коррекция дисбиотических изменений влагалища и кишечника оказалась эффективной у всех пациенток, у 8,8% — после двух курсов лечения.
Проспективное наблюдение в течение 3 лет выявили рецидивы заболевания у 14% девочек. Это были пациентки, которые впервые обратились к врачу в возрасте 6-7 лет с клиническими проявлениями вульвовагинита смешанной этиологии в стадии хронизации воспалительного процесса. В группе девочек, получавших превентивную иммунобиокоррекцию, развитие вульвовагинитов не регистрировалось.
Таким образом, у девочек первых 10 лет жизни с неспецифическими вульвовагинитами на фоне функциональных нарушений кишечника традиционные подходы к лечению данной патологии, предусматривающие коррекцию только нарушений микроценоза влагалища, недостаточно эффективны.
Оптимизация микробиоценоза кишечника у этой категории девочек комплексом лакто- и бифидосодержащих пробиотиков нового поколения и вифероном повышает эффективность коррекции микроценоза влагалища и снижает частоту рецидивов заболевания.
Превентивная коррекция дисбиотических нарушений влагалища у девочек группы риска по инфекционно-воспалительным заболеваниям наружных гениталий предупреждает развитие вульвовагинита у них.
Список литературы:
1. Кулаков В.И., Богданова Е.В. Руководство по гинекологии детей и подростков.-М.: Триада – Х, 2005.-336с.
2. Infections of the lower female genital tract during childhood and adolescence/ Deligeoroglou E., Salakos N., Matrakis E. et al // Clin Exp Obstetr Gynecol.-2004.-vol.31,№3.-p.175-178.
3. Гуркин Ю.А., Михайлова Л.Е. Вульвовагиниты у девочек / Ю.А. Гуркин, Л.Е. Михайлова.- СПбГПМА, 1998, 64 с.
4. Mehta A., Talwalkar J., Shetty C.V. Microbial flora of the vagina/ Mehta A., Talwalkar J., Shetty C.V. // Microecology and Therapy.- 1995.-vol.23.-p.1-7.
5. Изучение бифидофлоры влагалища у женщин репродуктивного возраста /В.М. Коршунов, З.А. Гудиева, Б.А. Ефимов и др. // ЖМЭИ.- 1999.-№4.- с.74-78.
6. Пробиотики и интерферон в поддержании здоровья населения /В.А. Алешин, Б.А. Шендеров, С.С. Афанасьев и др. // Международная конференция «Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Современное состояние и перспективы»: Тез. докл.- М, 2004 — с.3-5
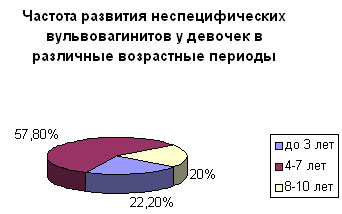
Схема применения бифидо и лактосодержащих пробиотиков и виферона при неспецифическом вульвовагините у девочек.
— на этапе клинических проявлений
| Препарат |
Доза в сутки |
Длит. |
Способ введения |
||
|
До 1 г. |
1-3 года |
Ст.3 лет | |||
|
Ацилакт |
2 |
4-6 |
10 |
14 |
Per vag |
|
лактобактерин |
2-4 |
6-8 |
10 |
14 |
Per vag |
|
Бифидумбактерин |
10 |
10-20 |
20 |
14-21 |
Per os |
|
Бифидумбактерин-форте |
15 |
20 |
20-25 |
14-28 |
Per os |
|
Бифилиз |
15 |
20 |
20-25 |
14-21 |
Per os |
|
Виферон |
300000 |
300000 |
300000 |
10 |
Per rec |
-на доклиническом этапе
| Препарат |
Доза в сутки |
Длит. курса |
Способ введения |
||
|
До 1 г. |
1-3 года |
Ст. 3 лет |
|||
|
лактобактерин |
2-3 |
3-4 |
4-10 |
10 |
Per vag |
|
Бифидумбактерин |
10 |
15 |
20 |
14 |
Рer os |
|
Виферон |
300000 |
300000 |
300000 |
7-10 |
Per rec |