Л.В.Крамарь, О.А.Карпухина.
Кафедра детских инфекционных болезней ВолгГМУ.
Инфекционный мононуклеоз (ИМ) – вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно–сосудистой, иммунной, систем, костного мозга, печени, селезенки и других органов [1].
Возбудителем инфекционного мононуклеоза является вирус Эпштейн-Барр (ВЭБ), который относится к семейству Herpesviridae, подсемейству Gamma Herpesviridae и роду Lymphocryptovirus. Но известно, что от 12% до 30% случаев ИМ негативно по гетерофильным антителам к ВЭБ. Схожую с инфекционным мононуклеозом симптоматику вызывают цитомегаловирус (ЦМВ) и вирус герпеса человека IV типа (ВГЧ-6). Инфекционный мононуклеоз возникает как первичная инфекция у иммунокомпетентных и иммуносупрессированных пациентов, или как реактивация инфекции у иммуносупрессированных больных [2].
Актуальность изучения инфекционного мононуклеоза обусловлена широкой циркуляцией возбудителей среди населения, специфической тропностью вирусов к иммунокомпетентным клеткам, отсутствием средств специфической профилактики и этиотропной терапии [3,8].
Лечение больных ВЭБ-инфекцией представляет большие трудности, так как ни один из известных противовирусных препаратов не позволяет полностью элиминировать вирус из организма. Длительная персистенция возбудителя приводит к негативной иммунной перестройке: угнетению реакций клеточного иммунитета, подавлению факторов неспецифической защиты организма, выражающейся в снижении ?- и ?-интерферон-продуцирующей способности лейкоцитов, гипоглобулинемии, сенсибилизации к антигенам вируса [4].
В настоящее время перспективными для лечения инфекционного мононуклеоза представляются генно-инженерные рекомбинантные ?-интерфероны (ИНФ), которые обладают антивирусным, антибактериальным, антипролиферативным и иммуномодулирующим действием. Кроме того, введение интерферона позволяет разгрузить пораженные клетки и компенсировать их неспособность к продукции собственного ИНФ в необходимых количествах [5]. Важным достоинством препаратов интерферона является их способность оказывать положительное влияние на иммунную систему при применении в невысоких терапевтических дозах. Кроме того, они хорошо сочетаются с другими лекарственными средствами, в том числе антибиотиками, имеют минимальный риск нежелательных эффектов при ректальном введении и могут назначаться детям любого возраста.
Одним из таких является отечественный препарат Виферон®. Входящие в его состав рекомбинантный интерферон альфа-2b, аскорбиновая кислота и токоферола ацетат оказывают выраженное элиминационное действие на возбудителя, предупреждают развитие возможных осложнений инфекционного мононуклеоза и способствуют нормализации иммунного статуса пациентов. Однако подход к проведению противовирусной и иммуномодулирующей терапии ИМ у детей должен быть дифференцированным и зависеть, прежде всего, от тяжести заболевания. По мнению некоторых авторов, при легких формах ИМ у больных повышена выработка собственного провоспалительного цитокина — ?-интерферона, достаточная для блокады репродукции вируса, поэтому этиотропная терапия в данном случае не является необходимой. При среднетяжелых и тяжелых формах, сопровождающихся значительной вирусной нагрузкой, их синтез в организме больного снижается, что приводит к нарушению клеточных механизмов противовирусной защиты, в связи с чем возрастает риск перехода ВЭБ-инфекции в хроническую форму. В этом случае уже в остром периоде ИМ оправдано назначение препаратов интерферона и его индукторов [6,7]. Малоизученным остается вопрос об интерфероновом статусе больных ИМ и не менее актуальным является определение роли терапии интерфероном-альфа данной патологии.
Цель исследования: оценить клиническую и лабораторную эффективность препарата Виферон®, суппозитории ректальные в дозировке 150000 МЕ при инфекционном мононуклеозе у детей.
Материал и методы
Под наблюдением находилось 80 детей больных острым инфекционным мононуклеозом средней степени тяжести в возрасте от 1 до 7 лет, проходивших стационарное лечение в Волгоградской областной детской клинической инфекционной больнице. В исследование включали пациентов, поступавших в клинику на 1-5 день от начала заболевания и не получавших в домашних условиях препаратов интерферона и иммуномодуляторов.
Все больные были разделены на 2 группы. В первую (опытную) было включено 40 человек, в комплексную терапию которых был добавлен отечественный препарат Виферон®, суппозитории ректальные в дозировке 150000 МЕ, применяемый по стандартной схеме: по одной свече 2 раза в день в течение 5 дней. Вторую составили 40 детей получавших только симптоматическое лечение.
Всем больным проводилось клиническое и лабораторное обследование, включающее в себя общий анализ крови и мочи, биохимические тесты (АЛТ, АСТ, тимоловые пробы). Уровень ?-интерферона сыворотки определялся 3 кратно – в день поступления, на 5 и 10 сутки от момента госпитализации. Верификацию возбудителя осуществляли с помощью молекулярно-генетического (ПЦР) метода исследования.
Результаты
При возрастном анализе наблюдаемых было установлено, что наиболее часто заболевание регистрировалось в возрасте от 1 до 3 лет — 80,0 % случаев. Изучение гендерного состава показало, что мальчики, по сравнению с девочками, болели ИМ вдвое чаще (67,5 % и 32,5 % соответственно).
Эпштейн-Барр вирусная этиология мононуклеоза методом ПЦР была подтверждена у всех заболевших. Обращала на себя внимание высокая частота встречаемости микст-инфекции, обусловленной ЭБВ и цитомегаловирусом одновременно (12,5%). При оценке преморбидного фона было выявлено, что 85,0% госпитализированных имели ту или иную сопутствующую патологию: хронические заболевания ЛОР-органов, кариес, дисбактериоза кишечника, 69,4% детей находились на диспансерном учете как часто болеющие, 47,5%. – имели поливалентную аллергию. На инфекции, вызванные вирусами семейства Herpesviridae, в анамнезе (ветряная оспа, афтозный стоматит, герпетическая инфекция 1 типа) указывали 38,2% обследованных.
До момента поступления в стационар всем детям проводилось амбулаторное лечение, которое наиболее часто включало в себя жаропонижающие средства (62,5%), антибиотики (55,0%), местные антисептики (55,0%), антигистаминные препараты (20,0%), деконгестанты (35,0%).
Клиническая картина ИМ на момент поступления в стационар была весьма разнообразной. Самым частым проявлением заболевания была лихорадка (100%), причем у 67,5% детей температура колебалась на субфебрильных цифрах, у 32,5% доходила до 39-400С, чаще повышалась вечером. Симптомы интоксикации, такие как слабость, вялость, сонливость, снижение аппетита, отмечались у 97,5% детей, причем у 12,5% они были сильно выражены, а у 85,0% — умеренно и слабо.
Поражение лимфоидной ткани, клинически проявляющееся увеличением размеров шейных лимфатических узлов, выявляли у 100% больных, при этом средний размер подчелюстных составлял 1,8 ±0,3 см, переднешейных — 1,3 ±0,2 см, заднешейных — 1,5 ±0,2 см.
У всех наблюдаемых детей была диагностирована лакунарная или пленчатая ангины, при этом у 32,5% больных воспалительные изменения в зеве проявлялись яркой гиперемией и болью в горле, у 12,5% с момента поступления выявляли обширные налеты на миндалинах. В половине наблюдений (57,5%) небные миндалины были гипертрофированы до II степени, у 35,0% – до III.
Симптомы аденоидита (заложенность носа, храп во сне) на момент поступления в стационар регистрировались у 97,5% детей. Уже к 3 дню комплексной терапии 72,5% обследуемых отмечали облегчение носового дыхания, исчезновение гнусавости голоса и храпа. Ринит, в виде прозрачного слизистого отделяемого из носовых ходов, носил кратковременный характер и чаще встречался у детей раннего возраста – от 1 года до 3-х лет (22,5%). В 15,0% случаев в остром периоде мононуклеоза была отмечена сыпь, при этом у всех их появление было связано с назначением антибактериальных препаратов пенициллинового ряда.
Симптомы гепато- и спленомегалии обнаруживались в 90,0 и 32,5% наблюдений. В среднем, край печени выступал из-под реберной дуги по средне-ключичной линии на 1,7±0,2 см, селезенки – на 1,8±0,2 см.
Табл. 1
Клиническая эффективность препарата Виферон ® у больных инфекционным мононуклеозом
|
Динамика основных клинических симптомов заболевания |
Опытная группа (Виферон) |
Контрольная группа (симптоматическая терапия) |
Достоверность различий |
| Длительность лихорадки, дни (M±m) |
2,2±0,4 |
3,7±0,3 |
p |
| Восстановление носового дыхания,
дни (M±m) |
3,4±0,6 |
4,3±0,4 |
p |
| Сокращение размеров печени, % |
62,5±0,3 |
58,4±0,5 |
p |
| Нормализация размеров селезенки, % |
27,5±0,4 |
24,6±0,3 |
p |
| Купирование гнойного тонзиллита, дни (M±m) |
3,0±0,2 |
4,1±0,3 |
p |
В табл. 1 представлены данные о клинической эффективности Виферона у лиц групп сравнения. Из ее данных видно, что основные симптомы заболевания быстрее купировались у детей, получавших лечение рекомбинантным интерфероном. Так, у 62,5% больных нормализация температуры наступала к второму-третьему дню терапии, у 37,5% совпадала с окончанием курса лечения. Средняя длительность лихорадочной реакции составила 2,2±0,4 дня, что было достоверно меньше, чем в контрольной группе (3,7±0,3, p9 в 1 мкл), лимфоцитоз и нейтропения. Атипичные мононуклеары — гематологический маркер инфекции, регистрировали у 60,0 % больных обеих групп. Их количество колебалось в широких пределах (от 2,0 до 41,0%), составляя в среднем 26,0±1,4%. У 32,2% выявляли тромбоцитопению, у 24,5 % — гипохромную анемию.
В таблицах 2 и 3 представлены результаты динамики клинических и биохимических анализов крови больных до и после лечения препаратом Виферон®.
Табл. 2
Клинические показатели крови больных опытной и контрольной групп.
|
Исследуемый показатель |
Опытная группа |
Контрольная группа |
||
|
|
До лечения |
После лечения |
До лечения |
После лечения |
| Лейкоциты
(109 /л в 1 мкл ) |
11,4±1,4 |
9,8±1,3 |
11,8±1,6 |
10,6±1,4* |
| Нейтрофилы
(109 /л в 1 мкл ) |
4,0±1,6 |
3,32±1,4 |
4,3±1,4 |
4,2±1,5 |
| Лимфоциты
(109 /л в 1 мкл ) |
5,4±1,4 |
5,37±1,5 |
5,6±1,3 |
5,5±1,7 |
| Моноциты
(109 /л в 1 мкл ) |
0,86±1,2 |
0,64±1,4 |
0,98±1,3 |
0,79±1,5* |
| Атипичные мононуклеары, % |
26,0±1,4 |
8,1±2,2 |
25,7±1,7 |
11,8±3,4* |
| Тромбоциты
(109 /л в 1 мкл ) |
187,5 ±4,7 |
222,1± 5,1 |
189,5 ±3,5 |
194,6± 6,2* |
| СОЭ (мм/час) |
13,5 ±2,1 |
11,2±0,9 |
14,2 ±3,2 |
12,7±0,7 |
Примечание: * — достоверность различий в показателях лиц групп сравнения после курса терапии Вифероном
Из данных табл. 2 можно видеть, что спустя 5 дней от начала терапии в периферической крови всех больных были отмечены положительные изменения: повышался уровень тромбоцитов, становился менее выраженным лейкоцитоз, уменьшалась СОЭ, постепенно исчезали атипичные мононуклеары. Однако у больных, получавших Виферон®, эти изменения происходили в более короткие сроки.
Аналогичная картина была установлена при сравнении результатов некоторых печеночных тестов. Так характерными для острого периода инфекционного мононуклеоза изменениями в биохимическом анализе крови были повышение уровня аминотрансфераз и тимоловой пробы. В таблице 3 приводятся средние значения показателей печеночных проб участников исследования на момент поступления и после курса терапии.
Табл.№3
Биохимические показатели крови детей больных инфекционным мононуклеозом в опытной и контрольной группах
|
Биохимический показатель |
Опытная группа |
Контрольная группа |
||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
| АЛТ Ед/л,
M±m |
51,3 ±9,8 |
30,9±8,4 |
50,2 ±7,6 |
42,7±8,1 * |
| АСТ Ед/л,
M±m |
71,9±7,4 |
43,0 ±7,2 |
73,0± 6,8 |
57,3 ±7,1 * |
| Тимоловая проба Ед., M±m |
4,3±0,9 |
3,8±0,8 |
4,2±0,7 |
4,0±0,9 |
Примечание: * — достоверность различий в показателях лиц групп сравнения после курса терапии Вифероном
Полученные биохимические данные свидетельствуют о более быстром купировании острого воспалительного процесса в паренхиме печени на фоне лечения препаратом Виферон®, суппозитории ректальные, в дозировке 150000 МЕ.
С внедрением в клиническую практику интерфероновой терапии высокую ценность приобрели исследования интерферонового статуса, который отражает характер изменений состояния организма в течение болезни. В норме у здоровых лиц альфа-интерферон в сыворотке крови отсутствует либо выявляется в «следовом» количестве. Во время острой фазы вирусных инфекций уровень концентрации альфа-ИНФ значительно возрастает у подавляющего большинства пациентов (до 200-300 пг/мл). При этом в период реконвалесценции концентрация альфа-ИНФ падает до нормального уровня (0-10 пг/мл) [7].
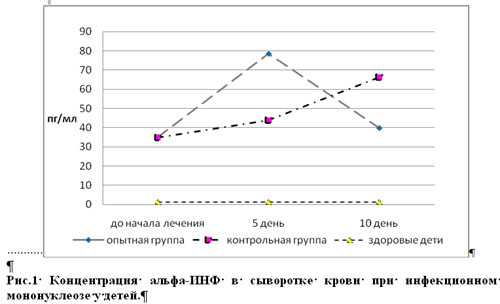
Для оценки интерферонового статуса у больных инфекционным мононуклеозом детей методом иммуноферментного анализа проводилось 3-х кратное определение концентрации альфа-ИНФ в остром периоде заболевания: в день поступления, на 5 и 10 сутки терапии. Полученные результаты приводятся на рисунке 2.
Предварительно проведенное нами исследование уровня ?-интерферона у 20 здоровых детей показало, что его содержание было крайне низким. Так у 13 человек он не определялся используемым методом, у 5 — его концентрация достигала 8,2±1,4 пг/мл, у 2 – 19,1±2,3 пг/мл сыворотки крови. Среднее содержание ?-ИНФ у здоровых детей составило 1,36±0,2 пг/мл. Уровни ?-интерферона в сыворотке крови у обследованных больных до лечения колебались от 2,1 до 215,9 пг/мл, при этом средний показатель в обеих группах не имел достоверных различий, составляя 35,2 ± 6,8 и 34,9± 9,8 пг/мл соответственно.
Через 5 дней от начала терапии данные показатели увеличивались у всех детей, однако максимальные значения были зарегистрированы у пациентов, получавших Виферон (78,6±7,4 против 43,9±5,8 пг/мл) (p
Таблица исходных данных (для графика)
| Опытная группа | Контрольная группа | |
| До лечения | 35,2 | 34,9 |
| На 5 день терапии | 78,6 | 43,9 |
| Через 10 дней | 39,8 | 66,4 |
Таким образом, полученные данные свидетельствуют о том, что использование в комплексной терапии больных инфекционным мононуклеозом рекомбинантного интерферона альфа-2b Виферона имеет целесообразность, подтвержденную клиническими и лабораторными данными. Препарат показал не только высокую эффективность, но и хорошую переносимость: в процессе лечения ни у одного больного не было отмечено никаких побочных действий.
Выводы:
- Виферон®, рекомбинантный интерферон альфа-2b приводит к более быстрому купированию симптомов ИМ, нормализации лабораторных показателей.
- Виферон® хорошо сочетается с симптоматической терапией, отличается высокой безопасностью и хорошей переносимостью.
- Исследуемый препарат положительно влияет на течение заболевания и может быть рекомендован для комплексного лечения ВЭБ – инфекции у детей.
Литература:
1. Эпштейна-Барр вирусная инфекция у детей / Э.Н.Симованьян и др. //Лечащий врач. — 2007. — №7 – С.36 – 41.
2. Инфекция, вызванная вирусом Эпштейна-Барр, у детей с острым респираторно-вирусным заболеванием и инфекционным мононуклеозом / Р.Е. Бошян, Н.В. Каражас, Л.В. Феклисова и др. // Омский Научный вестник. Приложение к выпуску шестьдесят первому. — 2007. — №3 (61). — С 74.
3. Герпесвирусная инфекция (эпидемиология, клиника, диагностика и лечение) / Н.В. Каражас, Н.А. Малышев, Н.Т. Рыбалкина и др. // Методические рекомендации. – М., 2007. – 42с.
4. Эпштейна-Барр вирусный гепатит у детей / В.Ф. Учайкин, А.В. Смирнов, С.Б. Чуелов и др. // Материалы VII конгресса педиатров–инфекционистов России «Актуальные вопросы инфекционной патологии и вакцинопрофилактики у детей». – М., 2008. –С.148.
5. Особенности функционального состояния печени при различных вариантах Эпштейна-Барр вирусной инфекции у детей / С.А. Хмилевская, И.А. Зайцева, Е.В. Михайлова // Инфекционные болезни. – 2010. – Т.8, №2 – С.30-35.
6. Хмилевская С.А. Эпштейна-Барр вирусный мононуклеоз: клинико-динамические особенности различных вариантов инфекции // Саратовский научно-медицинский журнал. – 2010. — № 3 — C.570-574.
7. Mossman K.?L., Ashkar A.?A. Herpesviruses and the innate immune response // Viral Immunol. — 2005. — Vol.18, № 2.- P.267-281.
8. Randall R.?E., Goodbourn S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures // J.?Gen. Virol. — 2008. -Vol.89. — P.41-47.