И.А. Московская, З.С. Карпова, В.А. Наумова,
Е.А. Григорьева, Г.Е. Холодняк, В.Н. Гражевский
Центр детской гепатологии, Тула
Перинатальная передача вирусов гепатитов В (HBV) и С (HCV) от матери ребенку может реализоваться пренатально (трансплацентарно), интранатально (во время родов) или постнатально – во время ухода за новорожденным [11].
Большинство проведенных в этой области исследований посвящено изучению риска инфицирования детей, родившихся у больных острой и хронической формами гепатитов, а также носителей различных маркеров вирусов [6, 12].
Клинические проблемы диагностики, лечения и исходов перинатального инфицирования, а также их связь с выраженностью проявлений гепатита у матери однозначного решения пока не получили. Р.Ю. Кольнер отмечала трудность дифференциальной диагностики гепатита у детей грудного возраста, что наряду с отсутствием настороженности врачей, нечеткостью клинических проявлений приводит к поздней госпитализации [5].
Наблюдение в динамике за пациентами, поступавшими в Детскую инфекционную больницу г. Тулы в первые месяцы после рождения, позволило нам накопить определенный опыт и оценить необычайную сложность для повседневной клинической практики проблем диагностики, лечения и профилактики перинатального инфицирования вирусами гепатитов [8].
Задачи настоящего исследования включают вопросы:
- Клинические проявления и исходы перинатальной HBV–инфекции.
- Частота перинатальной передачи младенцам HCV–инфекции и длительность циркуляции у них материнских специфических антител.
- Клинические проявления и исходы перинатальной HCV–инфекции.
- Клиническая эффективность интерферонотерапии при перинатальном инфицировании вирусами гепатитов В и С.
- Иммунологическая эффективность вакцины Engerix–B у рожденных женщинами с HBs –антигенемией.
Пациенты и методы.
В Детской инфекционной больнице Тулы организован диагностический блок, где госпитализируются дети первого года жизни, направленные с подозрением на вирусные гепатиты. Одновременно с детьми обследуются мамы. Определяется уровень общего, конъюгированного и неконъюгированного билирубина, активность гепатоцеллюлярных ферментов (АЛТ, АСТ), щелочной фосфатазы (ЩФ), содержание липопротеидов, протромбиновый индекс, тимоловая и сулемовая пробы, белковые фракции сыворотки крови. Этиологическую диагностику осуществляли с помощью серологических реакций на сифилис, токсоплазмоз и другие инфекции, с помощью тест–систем на основе иммуноферментного анализа (ИФА) – на ВИЧ, цитомегаловирусную инфекцию (anti–CMV IgM и IgG), вирусный гепатит А (anti–HAV), вирусный гепатит В (HBsAg, HBeAg, anti–HB cor IgM и суммарные) и вирусный гепатит С (anti–HCV) .

Маркеры репликации вирусов RNA HCV и DNA HBV методом полимеразной цепной реакции (ПЦР) определяли в НИИЭМ им. Н.Ф. Гамалеи РАМН, в ЦНИИЭ МЗ РФ. Количественное определение поствакцинальных антител (anti–HBs) проводили в ИКБ № 1 Москвы с помощью иммуноферментного анализа (ИФА) на автоматическом анализаторе COBAS CORE фирмы Hoffmann – La Roche с использованием тест–систем «Анти–HBs ИФА колич. COBAS CORE» той же фирмы в диапазонах: 0–10 мМЕ/мл, 10–100 мМЕ/мл, 101–500 мМЕ/мл, 501–1000 мМЕ/мл и >1000 мМЕ/мл. Концентрацию anti–HBs выше 10 мМЕ/мл считали протективной и расценивали как эффективный поствакцинальный ответ, ниже 10 мМЕ/мл – как недостаточную иммунологическую реакцию. Ультразвуковые исследования проводили на аппарате «Aloka–630».
Кроме определения обычных параметров, использовали методику денситометрии, сутью которой является количественная оценка эхоплотности ткани печени. Аппарат запоминает все эхосигналы из обрисованной «зоны интереса», на экране автоматически появляется гистограмма в виде графика и количественный показатель, характеризующий эхоплотность. Гистоплотность измерялась в области VIII cегмента спереди от v. portae, т.е. в стандартной зоне пункционной биопсии печени. Основанием для верификации перинатального инфицирования служили: обнаружение HBsAg, DNA HBV/RNA HCV, повышение активности цитолитических ферментов, характерные изменения количественных критериев эхографии печени.
По данным В.Ф. Учайкина с соавт. перинатальная инфекция HBV протекает в двух вариантах: преимущественно как персистентная малосимптомная инфекция с формированием так называемого первично–хронического гепатита и очень редко как манифестная острая циклическая инфекция. При манифестном врожденном гепатите В с рождения появляется выраженная желтуха, интенсивность которой быстро нарастает и продолжается от 2–3 недель до 2–3 месяцев [9]. У всех 42 детей, родившихся в Москве у женщин с персистирующей HBs–антигенемией и обследованных в динамике в клинике НИИ вирусологии, желтуха отсутствовала, клиническая симптоматика была скудной, гиперферментемия незначительной и не во вех случаях, HBs–антигене мия была транзиторной (максимальный период обнаружения HBsAg в крови – 144 дня) [11].
Среди наших пациентов перинатальный гепатит В диагностирован у 13 детей, в том числе у 2 завершивших курс вакцинопрофилактики против гепатита В. Матери 9 из них перенесли во время беременности острый вирусный гепатит В с исходом в выздоровление, у 4 диагностирован ХГВ.

Один ребенок, мама которого болела в 3 триместре беременности, в возрасте 3 месяцев был госпитализирован в отделение реанимации с клиникой фульминантного гепатита В, с летальным исходом. У 12 больных сформировался первично–хронический гепатит В. При оценке степени активности и стадии процесса мы использовали классификацию хронического гепатита у детей, предложенную В.Ф. Учайкиным с соавт [10]. Впервые госпитализированы в возрасте от 24 дней до 11 месяцев 7 больных, остальные в более старшем возрасте. Длительность наблюдения с момента госпитализации за 4 детьми полтора года, за двумя – 3,5 года, за шестью – 5–6 лет. Поводом для направления в стационар семи из них были гепато–лиенальный синдром, явления интоксикации, отставание в физическом развитии, изменения функции почек, пяти – обнаружение HBsAg при обследовании в связи с HBs–антигенемией у мамы во время беременности.
При поступлении общее состояние этих 12 больных расценивалось как средней тяжести, отмечались плотная консистенция и увеличение размеров печени (на 2–6 см), у 7 – увеличение селезенки. Желтухи ни у одного ребенка не было. Нарушения функции почек (у 9) при динамическом наблюдении расценены нефрологами, как проявления пиелонефрита или интерстициального нефрита, ассоциированного с HBV–инфекцией. Функциональные пробы печени были изменены у всех больных: повышение активности АЛТ до 2,2–20 норм, АСТ до 2–12, ЩФ до 1,5–2,3 норм, у четырех – холестерина и ?-липопротеидов. Диспротеинемия проявлялась повышением в сравнении с возрастной нормой и/или фракций глобулинов, снижением сулемовой пробы до 1,5–1,6 мл. Маркеры HBV–HBsAg, anti–HB cor Ig M – или Ig M + Ig G выявлены у всех больных, DNA HBV – у 11. При этом HBsAg определялся у всех больных в течение всего периода наблюдения, длительная (более 6 месяцев) репликативная активность HBV выявлена у 9.
При ультразвуковом исследовании печени у всех больных отмечено увеличение размеров, чаще за счет правой доли, повышение эхогенности паренхимы до 21 – 24 (в среднем 23±1,12 при возрастной норме 19,0±0,86), у 8 – закругление контуров, у 5 – уплотнение стенок воротной вены. Повышение гистоплотности паренхимы печени документировалось даже у самых маленьких (в возрасте 1 месяца) пациентов. При динамическом исследовании УЗ – картина соответствовала слабовыраженному фиброзу у 4, умеренному у 5, выраженному у 3 больных. Результаты морфологических исследований биоптатов печени у 3 больных соответствовали ультразвуковым признакам фиброза.
У 5 детей гепатит характеризовался низкой, у 2 умеренной, у 5 – выраженной активностью. У 3 из 5 детей с выраженной активностью ХГВ документировано антенатальное инфицирование, поскольку HBsAg у них был обнаружен на первом месяце жизни как перинатальный исход острого гепатита В у матерей.
Диагноз перинатального гепатита С чрезвычайно ответственен, поскольку определяет тактику ведения пациента, индивидуальный календарь прививок.
При HCV– инфекции дифференцировать транзиторное носительство материнских антител и перинатальное инфицирование крайне сложно. Специфический материнский иммуноглобулин класса IgG легко проходит через плацентарный барьер. Наиболее крупные молекулы из всех иммуноглобулинов IgM образуются в начале первичного иммунного ответа, первыми начинают синтезироваться в организме новорожденного и его определение при других инфекциях служит решению проблемы дифференциальной диагностики [2]. При ГС обнаружение IgM anti–HCV не может служить маркером острой инфекции. Отсутствие маркера, претендующего на роль «золотого стандарта» при остром гепатите С (в том числе в случае перинатального инфицирования) определяет необходимость комплексной оценки данных динамического наблюдения за пациентом [11]. По данным Горячевой Л.Г. с соавт. [3], в пользу перинатального инфицирования у обследованных в динамике 23 детей свидетельствовало выявление на 2–3 месяце низкоавидных антител и anti–NS3, NS4с уровнем менее 1,0 о.е., через 2–3 месяца уровень авидности и антител к NS3–Ag и NS4–Ag нарастал. Диагноз был подтвержден обнаружением RNA HCV и повышением активности цитолитических ферментов.

Рис. 1. Аминотрансферазы и маркеры HCV у больного перинатальным гепатитом СП.С.
родился 6.02.1996 года
Ребенок П.М. родился 5.08.1999 г, с рождения наблюдался, получал Виферон (рис. 2). В возрасте 2 лет 11 месяцев констатировано выздоровление с элиминацией anti–HCV.
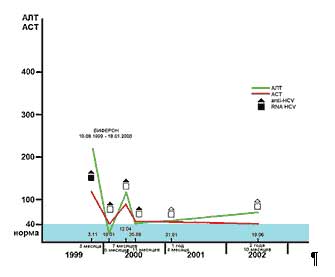
Рис. 2. Аминотрансферазы и маркеры HCV у больного перинатальным гепатитом СП.М.
родился 5.08.1999 года
Нет оснований для оптимизма в плане безусловного профилактического эффекта от вакцинопрофилактики ГВ у рожденных женщинами с HBs–антигенемией. По данным М.В. Базаровой с соавторами [1], у 15 из 235 (6,4%) обследованных детей, рожденных женщинами с HBs–антигенемией, в возрасте 12 месяцев (перед четвертой прививкой) был обнаружен HBsAg. Harrison T.J. и Zuckerman A.J. пришли к заключению, что в организме матери присутствуют варианты HBV с генетическими отклонениями. Составляя незначительную часть всей вирусной популяции, они ускользают от нейтрализации при элиминации вирусов дикого типа и затем становятся доминирующим вариантом у новорожденных. Ускользающие от поствакцинального иммунитета мутанты были выявлены у вакцинированных и инфицированных детей [13].
Мы проводили вакцинопрофилактику и клинико– лабораторное наблюдение за 57 детьми, рожденным женщинами с HBs –антигенемией. При проведении поствакцинального скрининга HBsAg при отсутствии протективных антител обнаружен у 2. У остальных 55 титр anti–HBs превысил 100 МЕ/л, у 47 (82,4%) – был более 1000 МЕ/л. Представляют интерес результаты динамического определения поствакцинального иммунитета у детей, родившихся у женщин с персистирующей НВs–антигенемией . У 11 обследованных после 1 и 2 введения введения вакцины антитела не обнаруживались. У 20 детей выполнено два исследования по количественному определению anti–НВs – через месяц после третьего введения вакцины (в возрасте 3 месяца) и через месяц после четвертой вакцинации (в возрасте 13 месяцев). После трех иммунизаций отмечена выработка антител. Исследование после четырех введений продемонстрировало значительный бустерный эффект. Концентрацию anti–НВs выше 1000 МЕ/л выявили у 84,6%. Длительность латентной фазы первичного иммунного ответа, во время которой происходит представление антигена иммунокомпетентным клеткам и запуск пролифервации антигенспецифичных клонов клеток–антителпродуцентов, должна учитываться при оценке риска для новорожденного реализации HBV–инфекции.
Таким образом, при перинатальной HBV– инфекции отмечено формирование хронического гепатита у 12, острый фульминантный гепатит у 1 больного.
Перинатальная передача вируса гепатита С документирована у 18 детей, рожденных женщинами с anti–HCV и RNA HCV. Из 18 у 4 перинатальное инфицирование клинически проявилось в форме острого гепатита (у 1 с исходом в ХГ), у 8 протекало с минимальными клиническими проявлениями, у 6 сформировался хронический гепатит с умеренной активностью.
Эффективность Виферона зависела от этиологии гепатита. Применение Виферона оказалось эффективным у 12 (80%) детей с перинатальным инфицированием HCV: у 8 (в том числе 3 с острым гепатитом) наступило выздоровление, у 4 – ремиссия. Из 10 получавших виферон по поводу перинатального первично–хронического гепатита В ремиссия наступила у 4. Отмечена хорошая переносимость и безвредность препарата.
Учитывая угрозу реализации перинатальной HBV– инфекции у рожденных женщинами с HBs –антигенемией, необходимо в процессе вакцинации определять HBsAg, проводить функциональные пробы печени.
Дети, рожденные женщинами с anti–HCV, должны находиться под наблюдением до исключения или верификации перинатальной инфекции с определением активности цитолитических ферментов, anti–HCV и RNA HCV не реже 1 раза в 3 месяца для своевременного назначения лечения.
Литература:
1. Базарова М.Ф., Шахгильдян И.В., Кузина Л.Е., Чешик С.Г. Вакцинопрофилактика гепатита В среди новорожденных, родившихся у женщин с персистирующей HBs – антитинемией. // Проблемы внутриутробной инфекции плода и новорожденного. : Материалы 111 съезда Российской ассоциации специалистов перинатальной медицины 11–13 сентября 2000 года, г.Москва.– М., 2000,с.241–243.
2. Воробьев А.А. /под редакцией/ Микробиология и иммунология. М,1999,420с
3. Горячева Л.Г., Шилова И.В, Мукомолова А.Л. Диагностика различных форм HCV–инфекции у детей. // Гепатит В,С и D – проблемы диагностики, лечения и профилактики. : Тезисы докладов V научно–практической конференции . М., 2003. с 65–66.
4. Ершова О.Н, Шахгильдян И.В., Кузин С.Н., Самохвалов Е.И, Кириллова И.Л., Розова А.В. Распространенность НС–вирусной инфекции у беременных женщин и частота перинатальной передачи вируса гепатита С. // Гепатит С (Российский консенсус):Тез. Докл. научно–практической конференции 26–27 сентября 2000 г.– М., 2000.– с.38–39
5. Кольнер Р.Ю. Болезнь Боткина у детей. Киев,1965. 255 с
6. Кузин С.Н. Сравнительная эпидемиологическая характеристика гепатитов с парентеральным механизмом передачи возбудителей в России и других странах СНГ: Автореф.дисс. … д–ра мед.наук.– М., 1998. –52с.
7. Малиновская В.В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и педиатрии при инфекционной патологии. Росс. вестник перинатологии и педиатрии, 1999, т.44, 3, 36–43
8. Московская И.А. HBV – инфекция у детей раннего возраста. //Педиатрия, 2003, № 3, с. 19–23.
9. Учайкин В.Ф., Нисевич Н.И., Чередниченко Т.В. Вирусные гепатиты от А до TTV у детей. М., 2003: 234–242, 418.
10. Учайкин В.Ф., Чередниченко Т.В., Писарев А.Г. Оценка течения хронического гепатита у детей.//Росс. Журнал гастроэнтерологии, гепатологии, колопроктологии, 2000 т Х, №2, с 48–53.
11. Шахгильдян И.В, Михайлов М.И.. Онищенко Г.Г. Парентеральные вирусные гепатиты. М.,2003: 196–203.
12. Шехтман М.М. Острые вирусные гепатиты: перинатальные исходы. // Акушерство и гинекология, 2000, № 4,с 3–6.
13. Harrison TJ, Zuckerman AJ. Hepatitis B virus antibodi escape mutants. // Drug News Perspect 1993; 6; 271–3.
14. Hitoshi Tajiri, Yoko Miyoshi, Shunpel Funato et al. Prospectiv studi of mother – to–infant transmisson of hepatitis C virus. // Pediatr Infect Dis J, 2001; 20:10–14.