Т.А. Чеботарева1, Л.Н. Мазанкова1, В.В. Малиновская2, С.К. Каряева3, В.В. Лазарев3
1. Кафедра детских инфекционных болезней ГОУ ДПО РМАПО Росздрава, Москва;
2. ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, Москва;
3. кафедра поликлинической педиатрии ГОУ ВПО СОГМА Росздрава, г. Владикавказ, РФ
В статье изложены результаты комплексного исследования системного иммунитета у здоровых и часто болеющих детей (ЧБД), проживающих в г. Владикавказе, и проведена оценка эффективности противо гриппозной вакцинации детей 2–6 лет с различным исходным состоянием иммунной системы. Выявлен ные до вакцинации изменения иммунитета требуют уточнения генеза и разработки региональных норм. Доказана клинико иммунологическая эффективность вакцинации против гриппа здоровых детей и ЧБД. Детям с измененным иммунитетом, а также из группы ЧБД, показано дополнительное к противогриппоз ной вакцине применение препарата Виферон для оптимизации течения поствакцинального периода.
Ключевые слова: здоровые и часто болеющие дети, иммунитет, вакцинация, грипп, ОРВИ, Виферон.
Острые респираторно вирусные инфекции (ОРВИ), а в их числе и грипп, занимают ведущее место в инфекционной патологии у детей и являют ся серьезной проблемой здравоохранения. По данным Федерального центра гигиены и эпидемиоло гии ФГУ Здравоохранения России, заболеваемость ОРВИ ежегодно составляет от 65 до 72 тыс случаев на 100 тыс детей в возрасте до 17 лет. Высоким риском инфицирования возбудителями ОРВИ характеризуются часто болеющие дети (ЧБД), формиру ющие особую группу диспансерного наблюдения.
Причиной частых ОРВИ у детей этой группы, как правило, служат сочетания различных факторов. Среди них наиболее значимыми являются генети ческая/конституциональная предрасположенность к повторным респираторным инфекциям, небла гоприятное перинатальное развитие, индивидуаль ные особенности иммунной системы, возрастные особенности системы интерферонов (ИФН), прехо дящие отклонения функциональной активности иммунитета, в т. ч. вследствие персистирующих или перенесенных интеркуррентных инфекций, наличия очага хронической инфекции, соматичес кой патологии, микроэлементозов, а также повы шенная антигенная нагрузка при посещении детских дошкольных или школьных учреждений, ран нее начало посещения детских организованных коллективов, неблагоприятное эпидемиологичес кое окружение в семье, экологическое неблагопо лучие, стресс. Последние из указанных факторов лежат в основе формирования аллергопатологии, вторичных иммунодефицитных состояний, очагов хронической инфекции ЛОР органов у детей. Изве стно, именно у этих детей высок риск развития неб лагоприятных исходов респираторного заболева ния, что в свою очередь замыкает порочный круг.
Именно у этих детей зачастую профилактика ОРВИ оказывается несостоятельной.
Улучшение результатов профилактики ОРВИ и гриппа является целью многих исследователей. Предлагаются различные варианты комбинированного использования специфических и неспеци фических средств – вакцин против гриппа и бакте риальных возбудителей острых респираторных инфекций (ОРИ), иммуномодуляторов (ИФН, пре паратов мембранных фракций). Комплексный подход позволяет снизить частоту интеркуррент ных инфекций в вакцинальном периоде у ЧБД [1, 2], детей с сопутствующей аллергопатологией [3–5], очагами ЛОР инфекции и сформировать ка чественный иммунный ответ на вакцинацию у де тей с отклонениями в иммунной системе [6, 7]. Наиболее часто отклонения в иммунном стату се выявляются у детей, проживающих в районах экологического неблагополучия, что обусловлено техногенными загрязнениями, приводящими к изменению окружающей среды. Республика Се верная Осетия–Алания расположена в предгорьях и на северных склонах Большого Кавказа и как все горные районы является особо уязвимой к ант ропогенному воздействию. В столице республики г. Владикавказе расположены два действующих предприятия цветной металлургии, выбрасываю щих в атмосферу химические вещества с различ ной специфической токсичностью. Высокий уро вень загрязнения почвы токсичными микроэле ментами отмечается на жилых территориях и детских игровых площадках [8–10].
Одной из наиболее чувствительных систем орга низма, чутко реагирующих на контакт с химичес кими веществами на самых ранних этапах, являет ся система иммунитета, выступающая как индика тор воздействия на организм различных антропо генных факторов. Экологическая ситуация в г. Вла дикавказе отличается крайним неблагополучием, а главные поллютанты, которыми являются тяжелые металлы, дают выраженный иммуносупрессорный эффект. Существует общая закономерность имму нотоксических реакций: воздействие многих ксено биотиков на развивающийся организм в раннем он тогенезе ведет к изменениям вилочковой железы и системы Т лимфоцитов, что коррелирует с повы шенным уровнем заболеваемости ОРИ. Их действие на более поздних стадиях онтогенеза и на зрелую иммунную систему в большей степени нарушает функцию В лимфоцитов и продукцию антител. Известно, что интеркуррентные заболевания в вакцинальный период возникают на фоне дисба ланса клеточного звена иммунитета, уменьшения продукции ИФН, поляризации Th1/Th2 в сторону нарастания IgE [11]. Указанные иммунологичес кие нарушения лежат в основе недостаточной эффективности вакцинации.

Для коррекции исходных изменений иммунологических параметров, профилактики осложненного течения вакцинации и стимуляции специфического антителообразова ния нами разработан способ противогриппозной вакцинации с дополнительным назначением пре парата Виферон за 5 предшествующих вакцина ции дней. Опыт применения Виферона свидетель ствует о его выраженном иммуномодулирующем и профилактическом в отношении как гриппа, так и более широкого диапазона ОРИ эффектах [12–14], что в сочетании с удобной формой (свечи ректаль ные) делает целесообразным его применение.
Перед началом эпидемического подъема заболе ваемости гриппом и ОРИ (октябрь–ноябрь 2006 г.) на базе детских поликлиник NoNo1, 3 и 4 г. Владикавка за проведена вакцинация против гриппа 86 детей в возрасте от 2 до 6 лет. Была использована гриппозная субъединичная вакцина. Препарат вводили внутри мышечно в наружную поверхность верхней трети плеча с помощью шприц доз в объеме 0,25 мл детям до 3 лет и 0,5 мл детям в возрасте от 3 до 6 лет одно кратно. В соответствии с рекомендациями ВОЗ для сезона 2006/2007 гг. одна доза вакцины содержала по 15 мкг гемагглютинина каждого из 3 эпидемичес ких штаммов вируса гриппа – А/Новая Каледо ния/20/99 (H1N1), А/Висконсин/67/05 (H3N2), В/Малайзия/2506/04. Вакцинации подлежали ус ловно здоровые дети, не имеющие противопоказаний к прививке. Хронические заболевания вне обостре ния зарегистрированы у 28 (32,6%) детей: хроничес кий аденоидит – у 10, хронический тонзиллит – у 7, аллергический ринит – у 2, поллиноз – у 1, аллерги ческий дерматит – у 8 (рис. 1).
Из исследования были исключены дети, получав шие иммуномодулирующие препараты в течение пре дыдущих 6 месяцев, и дети, имеющие противопоказа ния к вакцинации. Наиболее частыми причинами меди цинского отвода были острый период ОРИ и аллергия к белкам куриного яйца. Дети с тяжелыми сопутствую щими заболеваниями, которые могли повлиять на пока затели иммунитета, в разработку также не включались.
В оценке переносимости вакцинации применяли понятие вакцинальная реакция – совокупность стерео типных реакций организма в ответ на иммунизацию, протекающих доброкачественно и обратимых в корот кие сроки. Степень выраженности общих и местных реак ций определяли согласно требованиям МУ 3.3.2.1758 03 [15]. В течение 5 последующих после вакцинации суток ежедневно измеряли температуру тела и регистрирова ли общие и местные реакции.
Большую часть наблюдаемого контингента (48 человек – 55,8%) составили ЧБД. Включение ре бенка в группу ЧБД проводили на основании ана лиза данных анамнеза жизни по сведениям первич но отчетной медицинской документации и анкети рования родителей, используя критерии, разрабо танные В.Ю. Альбицким и А.А. Барановым (1986). Максимальное число эпизодов ОРИ в год составля ло 12, но чаще регистрировалось от 7 до 9 эпизодов – 54,2% ЧБД. У детей из группы ЧБД в 1,9 раз чаще, чем у эпизодически болеющих детей (ЭБД) выявля лись хронические очаги ЛОР органов (хроничес кий аденоидит, хронический тонзиллит).
Клинико иммунологическую оценку вакцинального процесса проводили с учетом исходного состояния здо ровья детей, с одной стороны, и наличия дефицита пара метров иммунитета – с другой.
Для оценки клеточного звена иммунитета опреде ляли общее количество лейкоцитов и лимфоцитов в % и в 1 мкл крови, количество Т лимфоцитов (CD3+), их субпопуляций (CD4+ и CD8+) и их соотношение – имму норегуляторный индекс (ИРИ), относительное и абсо лютное содержание натуральных киллеров (CD16+), ко личество CD25+, CD95+. Оценку клеточного звена им мунитета и его функциональной активности проводили до вакцинации методом проточной цитофлуориметрии на приборе FACScan фирмы Becton Dicinson (США) с ис пользованием комбинаций моноклональных антител научно производственных центров «МедБиоСпектр» и «Сорбент» к дифференцировочным и активационным маркерам, меченных FITC и фитоэритином.
Состояние гуморального иммунитета оценивали по количеству зрелых В лимфоцитов (CD19+) и интеграль ных показателей их функций: по уровню сывороточных IgM, G, A (Manchini G. et al., 1965).
Фагоцитарную активность нейтрофилов определя ли по их поглотительной способности убитой взвеси Staph. aureus Lepin. В окрашенных мазках подсчитыва ли % фагоцитоза, фагоцитарное число, также оценива ли завершенность фагоцитоза.
Противогриппозный иммунитет оценивали по уров ню специфических IgM и G относительно трех вакцин ных штаммов сезона до вакцинации, через 14 дней (IgM), через 1 мес и 6 мес после вакцинации путем постановки реакции торможения гемагглютинации (лаборатория этиологии и эпидемиологии гриппа НИИ вирусологии им. Д.И. Ивановского РАМН (зав. лаб. Е.И. Бурцева)). Вакцинированные дети составили 2 группы.
Детям 1 й группы (59 человек) вводили за 5 дней до вакцинации препарат Виферон в дозе 500 000 МЕ в суппозитории ректально 2 раза в день. Дети 2 й группы (27 человек) получали вакцину по общеп ринятой методике. Контрольная группа (20 здоро вых детей) вакцинацию не получала.
Каждую из групп для объективной оценки формирования специфического противогриппоз ного вакцинального иммунитета и иммуномоду лирующего эффекта цитокинотерапии на основании выявленных исходных нарушений в иммунитете делили на следующие подгруппы:
а) дети с нарушениями в иммунном статусе: 1а – 54 человека, 2а – 23 человека;
б) дети без нарушений в иммунном статусе: 1б – 5 человек, 2б – 4 человека.
Группы привитых были рандомизированы по характеристикам анамнеза, возрасту, полу и сос тоянию здоровья (наличие хронических очагов инфекции ЛОР органов, аллергопатологии).
Оценку эффективности специфической профилакти ки гриппа и протективного эффекта цитокинотерапии при новом способе вакцинации против гриппа проводили в течение последующего эпидемического сезона (6 меся цев после вакцинации), она включала характеристику вакцинального периода, регистрацию заболеваемости ОРИ и гриппом, влияние на тяжесть и продолжитель ность эпизодов ОРИ, расчет коэффициента эпидемиологи ческой эффективности, сроки появления и концентрацию противогриппозных иммуноглобулинов.
Статистический анализ проводили в лаборатории медицинской информатики ГУ НИИ неврологии РАМН (рук. – д.м.н. Реброва О.Ю.) с использованием пакета программ STATISTICA 6.0. (StatSoft Inc., США). Проведенный анализ иммунного статуса де тей, проживающих в г. Владикавказе, выявил у 89,5% из них различные иммунные нарушения, причем среди ЭБД они отмечались в 85,7% случа ев, среди ЧБД – в 90% случаев, у детей с аллерго патологией – в 81,8%, у детей с хроническими очагами инфекции ЛОР органов – в 100% случаев.
Выявленные разнообразные формы вторичной иммунной недостаточности носили как комбини рованный, так и изолированный характер (рис. 2).
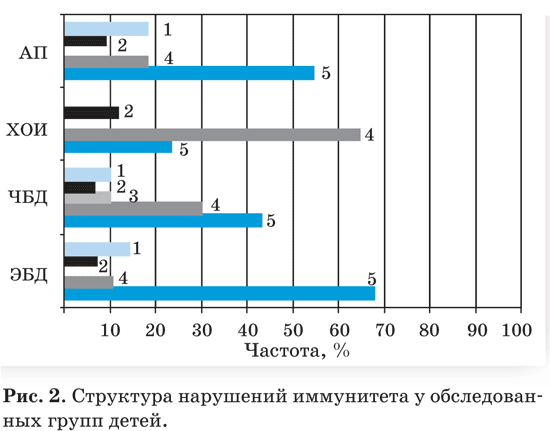
АП – дети с аллергопатологией, ХОЧ – дети с хроничес кими очагами инфекции ЛОР органов, 1 – норма, 2 – фагоцитарный иммунодефицит, 3 – гуморальный имму нодефицит, 4 – комбинированный иммунодефицит, 5 – клеточный иммунодефицит.
Наиболее значимые изменения иммунологичес ких параметров ЭБД и ЧБД отмечались в показате лях, характеризующих популяционный состав и функциональную активность Т лимфоцитов, и в меньшей степени затрагивали В лимфоциты и нейт рофилы. Более демонстративно достоверные разли чия регистрировались по уровню Т клеток, несущих CD3+ рецептор, количество которых было снижен ным как в абсолютных (р
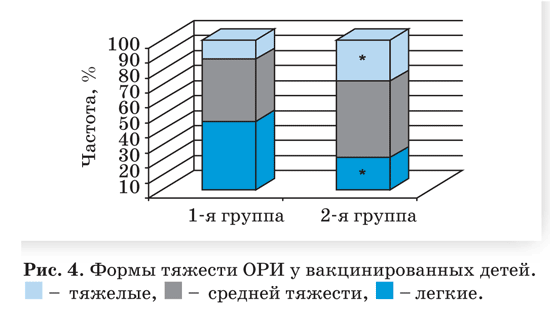
Достоверно реже в вакцинальном периоде бо лели ЧБД из 1 й группы (11,8% по сравнению с 57,1% ЧБД во 2 й группе, р
Продолжительность одного случая ОРИ коле балась от 5 до 22 дней и по средним показателям в 1 й группе составила 7,8±1,9 дней, во 2 й группе – 10,9 ± 4,3 дней (р>0,05). Продолжительность ли хорадки и других проявлений интоксикационного синдрома в 1 й группе была меньше в 2,4 раза, яв лений ринита – в 1,8 раза.
Оценка суммарных показателей эпидемиоло гической эффективности различных способов про филактики ОРИ у детей выявила положительное влияние цитокинотерапии на результаты вакци нации: индекс эффективности в 1 й группе соста вил 3,4 против 2,2 во 2 й группе (р1:40.
Исследование противогриппозного иммуните та до вакцинации показало, что у 89,5% детей ре гистрируются протективные уровни IgG против гриппа А (H3N2), у 81,4% – гриппа А (H1N1) и у 58,1% – против гриппа В. Диапазон величин, ус тановленных в этот срок, составил против гриппа А (H3N2) от 0 до 1:640, гриппа А (H1N1) – от 0 до 1:1280, гриппа В – от 0 до 1:640.
Столь высокая доля детей с протективными титрами противогриппозных IgG до вакцинации, вероятнее всего, обусловлена особенностями эпид сезона 2005/2006 гг. Он характеризовался позд ним началом в феврале 2006 г., имел затяжной ха рактер вплоть до середины весны (апрель–май) с пиком заболеваемости в марте 2006 г.
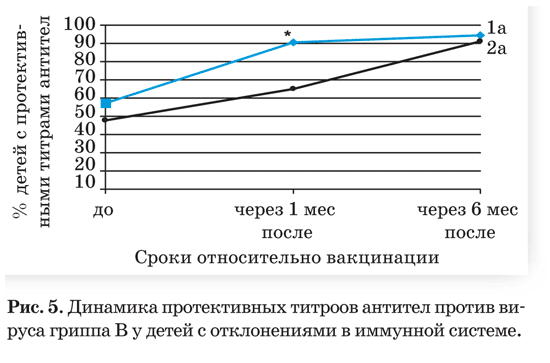
При исследовании противогриппозного имму нитета до вакцинации оказалось, что у всех детей без отклонений в иммунной системе обнаружива лись специфические IgG в титре 1:40 и более, тог да как у детей 1а и 2а подгрупп указанные титры диагностировались к вирусу гриппа А (H1N1) у 79,6 и 78,2% соответственно; к вирусу гриппа А (H3N2) – у 88,9% и 86,9% соответственно и к ви русу гриппа В – у 57,4% и 47,8% соответственно.
Динамика иммунного вакцинального ответа по числу лиц с титрами 1:40 и более у детей без отк лонений в иммунном статусе в группах значимо не различалась. Нарастание этого показателя через 1 мес после вакцинации отмечалось как у детей с нормальным иммунитетом, так и у детей с откло нениями в иммунной системе и оказалось досто верным по отношению к вирусу гриппа В в 1а подгруппе (рис. 5). Исследование, проведенное че рез 6 мес после вакцинации, не выявило достовер ных различий по группам, что свидетельствует о влиянии виферонотерапии на темп антителообра зования у детей с отклонениями в иммунной сис теме. Анализ появления «ранних» антител IgМ свидетельствовал также о преимуществе комбини рованной вакцинации у детей с отклонениями в иммунитете. Так, у 87,5% детей 1а подгруппы за регистрированы специфические IgM в титрах 1:40 – 1:320 против 40% детей с аналогичными титра ми в 2а подгруппе.
По числу сероконверсий также не выявлено достоверных различий по группам как через 1 мес после вакцинации, так и через 6 мес после нее. По динамике среднегеометрических титров противог риппозных IgG отмечалось сохранение исходных величин у вакцинированных детей, тогда как в группе контроля через 1 мес после вакцинации достоверно снижался этот показатель в отноше нии вируса гриппа В и через 6 мес после вакцина ции – в отношении вирусов гриппа А (H1N1) и В. Таким образом, обобщая полученные данные об иммунной системе детей 2–6 лет, проживающих в г. Владикавказе, и клинико иммунологической эффективности вакцинации против гриппа у них мож но сделать следующее заключение. Отличия иммун ного статуса детей, проживающих в г. Владикавка зе, в виде изолированных или комбинированных вторичных иммунодефицитов отмечается у 89,5% обследованных детей, что свидетельствует о целесо образности проведения дополнительных иммуноло гических исследований здоровых детей для разра ботки региональной нормы. Изменения клеточного звена выражались в достоверном снижении общего количества лимфоцитов, числа зрелых Т лимфоци тов (CD3+), а также лимфоцитов, экспрессирую щих рецепторы CD4+ и CD8+, с активацией ком пенсаторных механизмов в виде увеличения проли феративной и цитотоксической активности (CD25+).
Вакцинация против гриппа снижает заболевае мость ОРИ в последующие 6 месяцев в 1,6 раз. Про филактика гриппа с последовательным применени ем препарата Виферон и противогриппозной вакци ны предотвращает развитие интеркуррентных ОРИ в вакцинальном периоде, особенно у детей с изме ненным иммунитетом – в 3,9 раза и у детей из груп пы ЧБД – в 4,8 раза. При комбинированной вакци нопрофилактике по суммарным показателям выяв лено положительное влияние Виферона на частоту и тяжесть ОРИ, регистрируемых в эпидемический сезон. Особенности вакцинального иммунитета де тей с отклонениями иммунной системы и положи тельное влияние Виферона на вышеназванные пара метры позволяют считать целесообразным исполь зование его в качестве дополнения к вакцинации. Препарат следует назначать за 5 дней до вакцина ции против гриппа в дозе 500 000 ЕД детям 2–6 лет по 1 суппозиторию дважды в сутки.
ЛИТЕРАТУРА
1. Харит С.М., Черняева Т.В., Лакоткина Е.А. и др. Срав нительная оценка эффективности медикаментозной профи лактики осложнений коревой вакцинации у часто болеющих детей. Вопр. совр. пед. 2002; 3: 40–42.
2. Николаева А.Ю., Шамшева О.В. Пути оптимизации им мунного ответа на вакцинацию у часто болеющих детей. Детс кие инфекции. 2004; 4: 38–40.
3. Намазова Л.С., Таточенко В.К., Алексина С.Г. и др. Вакцинация против гриппа детей с отклонениями в состоянии здоровья и хроническими болезнями. Пед. фармакология. 2006; 3 (6): 30–34.
4. Ala Eldin H, Ahmed A, Nicholson KG et al. Influenza vac cination in patients with asthma: effect on peak expiratory flow. asthma symptoms and use of medication. Vaccine. 1997; 15 (9): 1008–1009.
5. Park CL, Frank AL, Sullivar M et al. Influenza vaccination of children during acute asthma exacerbation and concurrent prednisane therapy. Pediatrics. 1996; 98 (2): 196–200. Т.А. Чеботарева, Л.Н. Мазанкова, С.К. Каряева и др.
6. Костинов М.П. Иммунокоррекция вакцинального про цесса у лиц с нарушенным состоянием здоровья. М.: МдВ, 2006.
7. Podda A. The adjuvanted influenza vaccines with novel adjuvants: experience with the MF59 adjuvanted vaccine. Vaccine. 2001; 19.
8. Ревич Б.А., Авалиани С.Л., Тихонова Г.И. Экологичес кая эпидемиология. М.: Академия, 2004.
9. Менчинская О.В. Эколого геохимические аспекты тех ногенного загрязнения металлургических центров (на примере Владикавказа). Автореф. дис. … канд. геол. минерал. наук. М., 2004.
10. Дзеранова Р.Г. Особенности клинико иммунологичес кой и аллергологической характеристики детского населения Северной Осетии: Автореф. дисс. … канд. мед. наук. М., 2004.
11. Proietti E, Bracci L, Puzelli S et al. Type I IFN as a natu 111 ral adjuvant for a protective immune response: lessons from the influenza vaccine model. J. Immunol. 2002; 169: 375–383.
12. Колобухина Л.В. Виферон в лечении и профилактике острых респираторных вирусных инфекций. РМЖ. 2003; 11 (5): 306–308.
13. Чеботарева Т.А. Комбинированный метод профилак тики гриппа и ОРВИ у детей. Детские инфекции. 2004; 7 (2): 34–37.
14. Gutterman JU. Cytokine therapeutics: lessons from interferon alpha. PNAS USA. 91–98.
15. Методы определения показателей качества иммуноби ологических препаратов для профилактики и диагностики гриппа: Методические указания, введенные в действие Поста новлением Главного государственного санитарного врача РФ. М., 2004.
Authors present results of immune system complex study in healthy children and children with history of fre quent acute respiratory infections (FARI) in Vladikavkaz (North Ossetia) and estimate efficacy of anti influenza vaccination in children aged 2–6 years with different initial state of immune system. Changes of immune system detected before vaccination need in accurate definition of their genesis and in outwork of regional norms. Authors showed clinical and immunological efficacy of anti influenza vaccination both in healthy children and in FARI children. Viferon usage in addition to anti influenza vaccination is indicated cases of changed immunity state and in FARI children for optimization of post vaccinal period course.
Key words: healthy children, children with history of frequent acute respiratory infections, immunity, vac cination, influenza, Viferon.
Контактная информация:
Чеботарева Татьяна Александровна – канд. мед. наук, доц. каф. детских инфекционных болезней РМАПО
Адрес: г. Москва, ул. Героев Панфиловцев, 28 Тел.: (495) 949 17 22,
E mail: t_sheina@mail.ru