Локальная интерферонотерапия у детей с врожденными расщелинами губы и неба на разных этапах хирургического лечения
М. Н. Митропанова, кандидат медицинских наук
ФГБОУ ВО КубГМУ МЗ РФ, Краснодар
Резюме.
Лечение и реабилитация детей с врожденными расщелинами губы и неба, часто болеющих повторными острыми вирусными и бактериальными инфекциями респираторного тракта и ЛОР-органов, являются сложнейшей задачей и не теряют своей актуальности. При проведении оценки иммунного статуса у детей с врожденными расщелинами губы и неба выявлены дефекты функционирования иммунной системы. Разработана программа локальной интерферонотерапии, при оценке эффективности которой доказана высокая клинико-иммунологическая эффективность. Продемонстрировано снижение частоты повторных ОРВИ и значительное снижение частоты послеоперационных осложнений. Ключевые слова: врожденная расщелина губы и неба, комплексная реабилитация иммунокомпрометированные дети, клеточный и гуморальный иммунитет, иммунотропная терапия.
Ключевые слова: врожденная расщелина губы и неба, комплексная реабилитация, иммунокомпрометированные дети, клеточный и гуморальный иммунитет, иммунотропная терапия.
Abstract.
Treatment and rehabilitation of children with cleft lip and palate, who suffered from acute recurrent viral and bacterial respiratory tract and ENT-organs infections is one of the most complicated tasks. The local therapy by interferon was used both before and after surgical treatment: lubrication of the nasal passages and oral mucosa were carried out during 40 days ( 10 days before and 30days after surgical treatment). The priority in treating children with such diseases is given to the gradually increasing efficacy of rehabilitation and lowering post-operative complications and restoring the immune system functional activity. Keywords: congenital cleft lip and palate, complex rehabilitation, immunocompromised children, cellular and humoral immunity, local interferonotherapy.
Проблема лечения и реабилитации детей с врожденными расщелинами губы и неба, часто болеющих острыми вирусными и бактериальными инфекциями респираторного тракта и ЛОР-органов, является сложнейшей задачей и не теряет своей актуальности. Клинический анализ состояния детей с врожденными расщелинами губы и неба, находившихся под нашим динамичным наблюдением, показал, что на протяжении двух и более лет дети переносили 8 и более эпизодов осложненных и неосложненных острых респираторных вирусных инфекций (ОРВИ) в год с продолжительностью острого периода от 4 до 14 и более дней, что является клиническим индикатором иммунокомпрометированности [1–3]. Одним из приоритетных направлений в лечении таких детей является задача повышения эффективности этапной реабилитации при одновременном снижении послеоперационных осложнений и восстановлении функциональной активности нарушенных звеньев иммунной системы.
Патология системы интерферонов (ИФН) врожденного или приобретенного происхождения весьма многообразна. Многочисленными исследованиями последних лет убедительно показано существование первичных и вторичных приобретенных нарушений в системе ИФН, которые клинически проявляются нетипично протекающими вирусными и вирусно-бактериальными инфекциями. При этом развитие необычной клинической симптоматики следует за изменениями в системе ИФН, происходящими как на клеточном, так и на молекулярном уровнях. Наиболее широко в комплексе иммунореабилитационных мероприятий для иммунокомпрометированных детей с вирусными респираторными и герпетическими инфекциями используется рекомбинантный ИФН-α2b в сочетании с антиоксидантами — ВИФЕРОН, что обусловлено универсальным противовирусным, антибактериальным и иммуномодулирующим характером его действия [4–7].
Следует отметить, что в случае развития повторных ОРВИ с успехом используется глюкозмурамилдипептид (Ликопид) — бактериальный иммуномодулятор, в состав которого входит полусинтетический аналог минимального биологически активного фрагмента клеточной стенки бактерий. В целом иммуномодуляторы бактериального происхождения имеют мультинаправленный механизм действия, который обусловлен стимуляцией фагоцитов, естественных клеток-киллеров (ЕКК) и повышением продукции интерферона, что позволяет назначать их также и при бактериальных осложнениях ОРВИ или при обострении хронических заболеваний ЛОР-органов. При этом показано, что бактериальные иммуномодуляторы потенцируют эффект антибиотиков при их одновременном использовании [8–12].
Целью настоящего исследования была оценка эффективности разработанной программы локальной интерферонотерапии, включенной в комплекс реабилитационных мероприятий, у иммунокомпрометированных детей с врожденными расщелинами губы и неба на разных этапах хирургического лечения.
Материалы и методы исследования
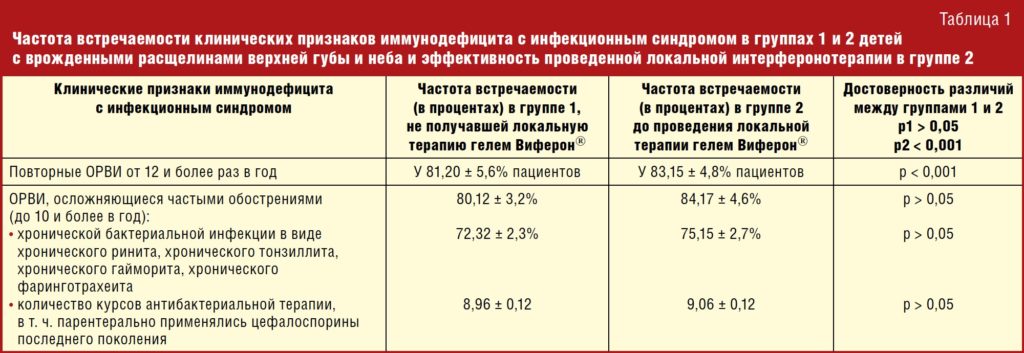
Под нашим клиническим наблюдением находились дети (20 мальчиков и девочек) в возрасте от 1 до 3 лет с врожденной расщелиной губы и неба, имеющие клинические признаки иммунодефицита с инфекционным синдромом, которые составили группу 1.
В группу 2 вошли 30 детей с врожденной расщелиной губы и неба (после хейлопластики, до и после велопластики и/или уранопластики), имеющих клинические признаки иммунодефицита с инфекционным синдромом, находившихся на разных этапах хирургического лечения в отделении челюстно-лицевой хирургии детской Краевой клинической больницы г. Краснодара (ЧЛХ ДККБ). Всем детям этой группы проведено исследование состояния иммунной системы до и после применения локальной интерферонотерапии носо- и ротоглотки, в т. ч. и после проведения хирургического лечения.
Группу контроля составили 20 условно здоровых детей обоего пола, соответствующего возраста.
Проведено тестирование состояния Т-клеточного (CD3+CD19—, CD3+CD4+, CD3+CD8+, CD4+/CD8+), В‑лимфоцитов (CD3‑CD19+), ЕКК — CD3‑CD16+CD56+), определялся уровень сывороточных IgA-, IgG-, IgM-звеньев по сравнению с группой контроля. Исследование фагоцитарной функции нейтрофильных гранулоцитов (НГ) проводили в соответствии с методическими рекомендациями (Нестерова И. В. и др., 1992), тестировали содержание активнофагоцитирующих нейтрофилов — относительное (% ФАН) и абсолютное количество (ФАН абс.); для характеристики объема захваченного бактериального материала (Staphylococcus aureus, штамм 209) определяли фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ); для оценки киллинговой активности и уровня переваривания определялся процент переваривания (% П), индекс переваривания (ИП). Активность микробицидных систем НГ, с оценкой их способности к реализации цитотоксического и цитолитического потенциала, тестировалась с использованием функциональных нагрузочных тестов в системе in vitro. В зависимости от уровня активности NADРН-оксидазы в спонтанном и стимулированном NBTтесте (индукция Staphylococcus aureus, штамм 209) определялся средний цитохимический индекс — СЦИ, рассчитывался коэффициент мобилизации — КМ:% ФПКcт(NBTст)/%ФПКсп(NBTсп).
Статистическую обработку полученных результатов проводили с помощью компьютерных программ Microsoft Exel, StatPlus 2009 с применением непараметрических тестов Вилкоксона и Манна–Уитни. Результаты представляли в виде медианы (верхний и нижний квартиль) (Me [Q1; Q3]). Достоверность различия определяли при p
Результаты исследования
Группа детей 1 (20 мальчиков и девочек в возрасте от 1 до 3 лет с врожденной расщелиной губы и неба, имеющих клинические признаки иммунодефицита с инфекционным синдромом: повторные ОРВИ от 10 и более раз в год, осложняющиеся частыми обострениями (до 10 и более в год) хронической бактериальной инфекции в виде хронического ринита, хронического тонзиллита, хронического гайморита, хронического фаринготрахеита. Дети получали в год от 6 до 8 и более курсов антибактериальной терапии, в т. ч. парентерально применялись цефалоспорины последнего поколения. Проведение различных этапов хирургического лечения часто осложнялось нагноением и/или расхождением швов, длительными курсами антибактериальной терапии, длительным периодом пребывания в стационаре, затяжным периодом реабилитации.
Группа детей 2 (30 девочек и мальчиков в возрасте от 1 до 3 лет) с врожденной расщелиной губы и неба, имеющих клинические признаки иммунодефицита с инфекционным синдромом: повторные ОРВИ от 10 и более раз в год, осложняющиеся частыми обострениями (до 10 и более в год) хронической бактериальной инфекции в виде хронического ринита, хронического тонзиллита, хронического гайморита, хронического фаринготрахеита. Дети получали в год от 6 до 8 и более курсов антибактериальной терапии, в т. ч. парентерально применялись цефалоспорины последнего поколения.
Таким образом, в обеих исследуемых группах детей имели место клинические критерии иммунодефицита с инфекционным синдромом (табл. 1).
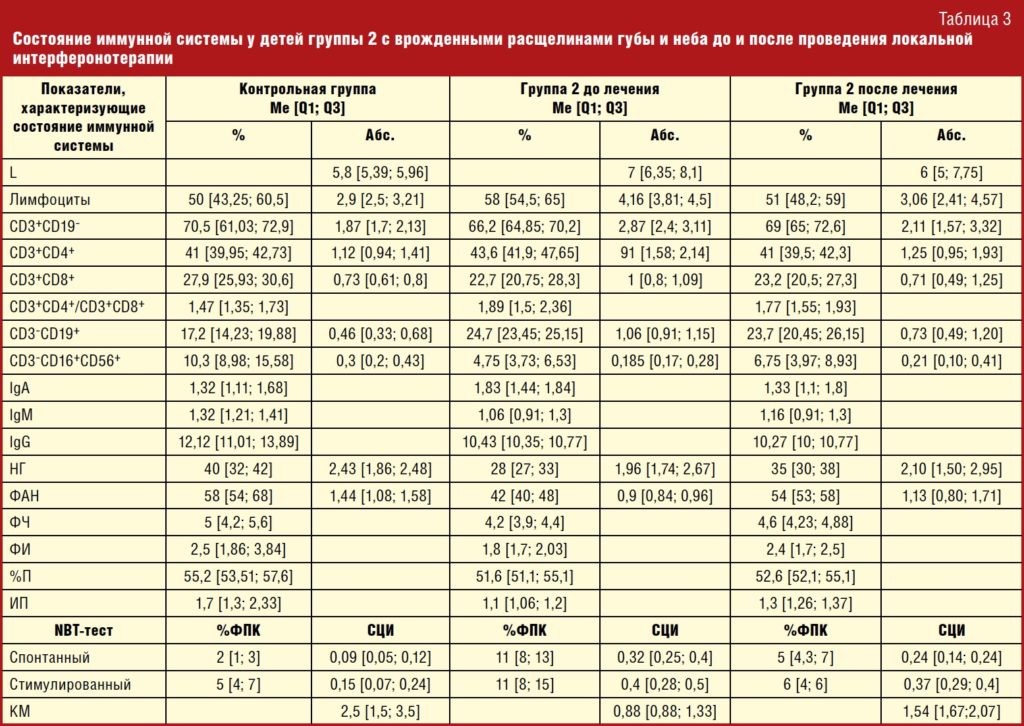
Оценка состояния иммунной системы у детей группы 2 с врожденной расщелиной губы и неба, находившихся на этапном лечении, показала наличие дефектов клеточного противовирусного иммунитета: выраженный дефицит клеток с цитотоксической активностью — CD3+CD8+ Т-лимфоцитов и ЕКК. Кроме того, имело место отсутствие адекватного ответа на инфекционный воспалительный процесс со стороны IgM и IgG на фоне высокого уровня IgA и нарушения фагоцитарной и микробицидной функции НГ, проявляющихся дисбалансом поглотительной и киллинговой активности с нарушением микробицидной активности. Не исключено, что эти нарушения могут носить врожденный характер. Установленные дефекты функционирования иммунной системы (врожденные или приобретенные) обуславливают необходимость включения иммунотропной терапии на различных этапах хирургического лечения с целью увеличения эффективности реабилитации пациентов с расщелинами губы и неба, заключающейся в профилактике послеоперационных осложнений и повторных респираторных инфекций, возможности реставрации нарушений в иммунной системе [13–16].
Учитывая выявленные дефекты функционирования противовирусного иммунитета, наличие клинических критериев иммунодефицита с инфекционным синдромом и особенности клинического статуса пациентов, находившихся на разных этапах хирургического лечения врожденной расщелины губы и неба, нами разработана программа локальной интерферонотерапии с целью профилактики возникновения ОРВИ и снижения частоты возникновения бактериальных инфекций носо- и ротоглотки, а также частоты возникновения послеоперационных осложнений.
У детей группы 2 был использован локально рекомбинантный ИФН-α2b в сочетании с антиоксидантом (α-токоферола ацетат) — гель ВИФЕРОН — смазывание слизистой ротовой полости и носа 3–4 раза в день за 10 дней до хирургического лечения и в течение 1 месяца после хирургического лечения, начиная со вторых послеоперационных суток.
Общая продолжительность курса локальной интерферонотерапии до и после хирургического лечения составила 1 месяц и 10 дней (табл. 1).
Антибактериальная терапия назначалась эмпирически с учетом современных сведений о резистентности возбудителей к некоторым антибактериальным препаратам. В последующем проводилась коррекция антибактериальной терапии по результатам бактериологического исследования (посева микрофлоры полости рта, полости носа и носоглотки) и определения чувствительности к антибиотикам. Препаратами выбора были антибактериальные средства из группы цефалоспоринов: цефтриаксон (Лифаксон, Цефаксон, Азаран) и др. Доза препарата и длительность применения определялись возрастом ребенка, его весом, сопутствующей соматической патологией и характером послеоперационных осложнений.
После проведения комплексного лечения с включением локальной интерферонотерапии рекомбинантным ИФН-α2b — гелем ВИФЕРОН детей группы 2 с врожденной расщелиной губы и неба, находившихся на разных этапах хирургического лечения, установлены следующие изменения в состоянии клеточного и гуморального иммунитета. Так, после проведения локальной интерферонотерапии у детей группы 2 отмечена нормализация ранее повышенного общего количества лейкоцитов с 7 × 109 [6,35; 8,1] до 6 × 109 [5; 7,75] против 5,8 × 109 [5,39; 5,96] в контроле, абсолютного количества зрелых Т-лимфоцитов (CD3+CD19—) с 2,87 × 109 [2,4; 3,11] до 2,11 × 109 [1,57; 3,32] против 1,87 × 109 [1,7; 2,13] в контроле. Среди субпопуляций Т-лимфоцитов уменьшилось до уровня контроля абсолютное содержание СD3+СD4+ лимфоцитов (с 1,91 × 109 [1,58; 2,14] до 1,25 × 109 [0,95; 1,93] против 1,12 × 109 [0,94; 1,41] в контроле), что сгладило дисбаланс между клетками с хелперной и цитотоксической активностью — ИРИ 1,89 [1,5; 2,36] до лечения 1,77 [1,55; 1,93] после лечения против 1,47 [1,35; 1,73] в контроле. При имеющемся существенном дефиците относительного (в 2,2 раза) и абсолютного (в 1,6 раза) количества CD3‑CD16+CD56+ — ЕКК, отвечающих за цитотоксические клеточные реакции, выявлена лишь тенденция к повышению их количества, однако восстановления этих клеток до показателей здоровых детей не произошло (ЕКК% с 4,75% [3,73; 6,53] до 6,75% [3,97; 8,93] против 10,3% [8,98; 15,58] в контроле и ЕКК абс. с 0,19 × 109 [0,17; 0,28] до 0,21 × 109 [0,1; 0,41] против 0,35 × 109 [0,2; 0,43] в контроле). Снизилось абсолютное количество CD3‑CD19+ В‑лимфоцитов с 1 × 109 [0,91; 1,15] до 0,79 × 109 [0,49; 1,2] против 0,51 × 109 [0,33; 0,68] в контроле, и при этом изменения в гуморальном иммунитете связаны со снижением уровня сывороточного IgA с 1,83 г/л [1,44; 1,84] до 1,33 г/л [1,1; 1,8] против уровня контроля 1,38 г/л [1,11; 1,68] и восстановлением сниженных уровней сывороточных IgM и IgG (табл. 2).
В результате проведенного лечения, включающего локальную терапию гелем ВИФЕРОН, увеличилось до контрольных значений как относительное и абсолютное количество циркулирующих НГ (НГ%, НГ абс.) с 28% [27; 33]; 1,96 × 109 [1,74; 2,15] до 35% [30; 38]; 2,1 × 109 [1,5; 2,95] против 40% [32; 42]; 2,43 × 109 [1,86; 2,48] в контроле, так и содержание активно фагоцитирующих НГ (% ФАН, ФАН абс. — с 42% [40; 48]; 0,9 × 109 [0,84; 0,96] до 54% [53; 58]; 1,13 × 109 [0,8; 1,71] против 58% [54; 68]; 1,44 × 109 [1,08; 1,58] в контроле соответственно). При этом и показатели поглощающей способности НГ (ФЧ, ФИ), и показатели, характеризующие переваривающую способность НГ, не изменялись по отношению к таким же показателям детей группы 1 до лечения и относительно здоровых детей. Выявленная до лечения напряженность NADPH-оксидазной микробицидной активности НГ в спонтанном NBT-тесте до лечения (СЦИсп — 0,32 [0,25; 0,4], %ФПКсп — 11 [8; 13]) несколько снизилась после лечения СЦИсп — 0,24 [0,14; 0,24], %ФПКсп — 5 [4,3; 7], но оставалась выше показателей здоровых детей (СЦИсп — 0,09 [0,05; 0,12], %ФПКсп — 2 [1; 3]) и при дополнительной антигенной нагрузке сохранялся адекватный ответ NADPH-оксидаз, что отразилось в тенденции к нормализации КМ (с 0,88 [0,88; 1,33] до 1,54 [1,67; 2,07] против 2,5 [1,5; 3,5] у здоровых детей соответствующей возрастной группы (рис.).
Проведение комплексного лечения позволяет компенсировать нарушения, обусловленные как функциональной незрелостью иммунной системы, так и формированием различных дефектов ввиду наличия частых респираторных инфекций на фоне врожденной расщелины губы и неба. Выявлены позитивные изменения изучаемых иммунологических показателей у детей группы 2, прежде всего со стороны Т-клеточного и гуморального иммунитета, фагоцитарной функции НГ, что клинически сопровождалось отсутствием различных осложнений послеоперационного периода, в том числе сокращением респираторной заболеваемости (табл. 3).
Включение в комплексное лечение локальной интерферонотерапии гелем ВИФЕРОН продемонстрировало выраженный клинический эффект, выражающийся в снижении частоты ОРВИ в 75,18 ± 2,335% случаев, а также частоты обострений хронических очагов инфекции верхних дыхательных путей в 63,14 ± 4,53% случаев, уменьшении количества послеоперационных осложнений (нагноение швов, расхождение швов) у всех пациентов этой группы — 100,00% случаев, более быстром заживлении послеоперационной раны у всех пациентов, сокращении времени пребывания в стационаре на 25,34 ± 0,98% по сравнению с группой 1, не получавшей локальную терапию гелем ВИФЕРОН (p 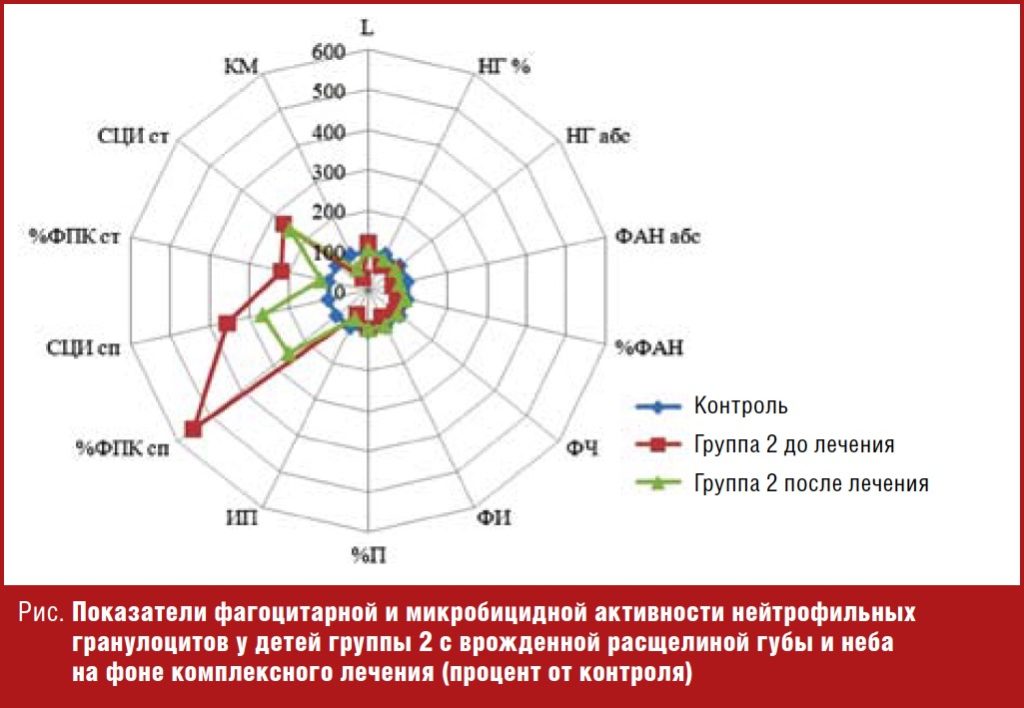
Выводы
- Анализ состояния иммунной системы при врожденной расщелине губы и неба у иммунокомпрометированных детей, находящихся на разных этапах реабилитации, позволил выявить различные нарушения, проявляющиеся дисбалансом противовирусного и противобактериального иммунитета: снижением ЕКК CD16+CD56+, снижением цитотоксических Т-лимфоцитов, неадекватным ответом со стороны IgG и IgM на фоне повышения уровня сывороточного IgA, дефектом фагоцитарной функции НГ, напряженностью микробицидной активности НГ.
- Разработанная тактика локальной интерферонотерапии, проводимой с использованием геля ВИФЕРОН, позволила достичь умеренного позитивного модулирующего эффекта относительно всех звеньев иммунной системы.
- Включение в комплексное лечение локальной интерферонотерапии гелем ВИФЕРОН продемонстрировало выраженный протективный клинический эффект, выражающийся в снижении частоты ОРВИ, уменьшении количества послеоперационных осложнений, сокращении времени пребывания в стационаре, снижении длительности применения антибактериальных препаратов, уменьшении количества обострений хронических очагов бактериальной инфекции.
- Позитивная клиническая эффективность локальной интерферонотерапии в процессе этапной реабилитации детей с врожденной расщелиной губы и неба позволяет в первую очередь своевременно оказать хирургическую помощь детям с данной патологией, избежать негативных клинических последствий на этапе восстановления после проведенного хирургического лечения и в то же время повысить резистентность к респираторным инфекциям.
Литература
- Koenders M., Lubberts E., Oppers-Walgreen В. Blocking of IL17 during reactivation of experimental arthritis prevents jount inflammation and bone erosion by decreasing RANKL and IL-1 // Am. J. Pathol. 2005. Vol. 167. P. 141–149.
- Marie-P. J. Osteoblasts and bone formation/Advances in organ biology: molecular and cellular biology of bone. Stamford, CT (USA): JAI Press, 1999. № 5 B. P. 401–427.
- Seibel M. J., Robins S. P., Bilezikian J. P. Dynamics of bone and cartilage metabolism. 2 nd ed. Elsevier, San Diego, 2006. P. 919.
- Нестерова И. В., Малиновская В. В., Тараканов В. А., Ковалева С. В. Интерфероно- и иммунотерапия в практике лечения часто и длительно болеющих детей и взрослых. Capricorn Publishing Inc., 2004.
- Захарова И. Н., Чебуркин А. В., Малиновская В. В. и др. Значение системы интерферонов в формировании иммунного ответа у детей с острыми респираторными вирусными инфекциями // Вопросы практической педиатрии. 2009: 4 (6): 38–45.
- Караулов А. В., Кокушков Д. В. Иммуномодуляторы: классификация, принципы и практика применения при инфекции дыхательных путей у детей // Детские инфекции. 2007: 6 (4): 68–74.
- Учайкин В. Ф. Информационное письмо. Усовершенствованный способ лечения острых респираторных вирусных инфекций, в том числе гриппа у детей, имеющих функциональные и морфофункциональные отклонения в состоянии здоровья (относящихся к II–IV группам здоровья). Информационное письмо. М., 2012.
- Нестерова И. В., Клещенко Е. И., Ковалева С. В. и др. Проблемы лечения вирусно-бактериальных инфекций у часто и длительно болеющих иммунокомпрометированных детей // Российский аллергологический журнал. 2011; 2: 86–93.
- Савенкова М. С., Афанасьева А. А., Абрамова Н. А. Иммунотерапия: лечение и профилактика вирусных инфекций у часто и длительно болеющих взрослых и детей // Аллергология и иммунология. 2012; 1 (1): 20–27.
- Нестерова И. В., Ковалева С. В., Колесникова Н. В. и др. Эффективность программы интерфероно- и иммунотерапии у детей с ассоциированными повторными острыми вирусными респираторными, рецидивирующими герпесвирусными инфекциями и хроническими заболеваниями ЛОР-органов // Российский аллергологический журнал. 2013; 2 (2): 213–216.
- Nesterova I. V, Kovaleva S. V., Kolesnikova N. V, Kleshchenko E. I., Shinkareva O. N, Chudilova G. A., Lomtatidze L. V., Kokova L. N. Optimization of interferonand immunotherapy in immunocompromised children with associated viral infections. In: Allergy, asthma & im-munophysiology: from basic science to clinical management. Medimond International Proceedings, 2013. P. 101–104.
- Nesterova I., Klethshenko E., Alekseeva O., Sepiashvili R. Y Interferons and viruses: defense and attack. Interferon and immune-therapy in counter-defense against recurrent and latent viral and viral-bacterial infections In: Allergy, asthma & immunology: from genes to clinical application, Monduzzieditore. Medimond International Proceedings. 2011. P. 237–242.
- Митропанова М. Н. Особенности функционирования иммунной системы у детей с врожденными расщелинами губы и неба на этапах хирургического лечения // Стоматология детского возраста и профилактика. 2017, т. XVI, 2 (61), с. 79–83.
- Нестерова И. В. Препараты интерферона альфа в клинической практике: когда и как // Лечащий врач. 2017. № 9. С. 66–76.
- Нестерова И. В., Ковалева С. В., Клещенко Е. И., Чудилова Г. А., Ломтатидзе Л. В., Шинкарева О. Н., Парфенов В. В., Кольцов В. Д. Оптимизация тактики интерфероно- и иммунотерапии в реабилитации иммунокомпрометированных детей с повторными респираторными и герпетическими вирусными инфекциями // Педиатрия. 2014. Т. 93, № 3. С. 66–72.
- Marcus R., Feldman D., Nelson D. et al. Fundamentals of osteoporosis. 3 rd ed., Vol. 1. Elsevier, San Diego, 2008. P. 1941.
Впервые опубликовано в журнале «Лечащий врач» № 1, 2018, С. 6–12, www.lvrach.ru/2018/01/