И.Н. Захарова, Л.Б. Торшхоева, А.Л. Заплатников, Н.А. Коровина, В.В. Малиновская, Т.А. Чеботарева, Н.С. Глухарева, Х.И. Курбанова, Н.С. Короид, Е.Н. Выжлова.
ГОУ ДПО Российская медицинская академия последипломного образования Росздрава.
ФГБУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздравсоцразвития.
Тушинская детская городская больница, Москва.
В статье изложены результаты изучения ключевого звена иммунопатогенеза острых респираторных инфекций (ОРИ) у детей – интерферонового статуса. Выявленные изменения показателей интерфероногенеза в период разгара ОРИ в сыворотке крови и в назальных смывах обосновывают совершенствование подходов к интерферонотерапии. На основе доказанной клинико-иммунологической эффективности разработан модифицированный способ интерферонотерапии с одновременным применением назальной мази и высоких доз интерферона в ректальных суппозиториях.
Острые респираторные инфекции (ОРИ) занимают ведущее место в структуре инфекционной патологии у детей [1-3]. Высокая заболеваемость ОРИ объясняется легкостью передачи инфекции, многообразием респираторных вирусов и их антигенной изменчивостью, наличием большого количества пневмотропных бактерий, а также возможностью длительной персистенции возбудителей на фоне возрастных особенностей иммунитета (незрелость, «поздний старт», отсутствие предшествующего иммунологического опыта) [4]. Учитывая широкое распространение ОРИ в педиатрической популяции и высокий риск развития тяжелых форм заболевания, особенно у детей раннего возраста, вопросы, связанные с разработкой эффективных способов предупреждения и терапии острых респираторных инфекций, по-прежнему сохраняют свою актуальность [5-8]. Принимая во внимание, что система интерферона – важнейшее звено врожденного иммунитета, использование интерферона или его индукторов при лечении детей с ОРИ является одним из наиболее перспективных направлений [9-18]. При этом в педиатрической практике особое место занимает ВИФЕРОН® – генно-инженерный интерферон альфа-2b, безопасность и эффективность которого, как при эндоназальном (в виде мази и геля), так и при ректальном (в виде суппозиториев) использовании у детей доказана в ряде исследований [15, 19-21]. Целью настоящего исследования явилось изучение клинико-иммунологической результативности различных схем комбинированного применения (эндоназально + ректально) Виферона при лечении детей с острыми респираторными инфекциями.
Материалы и методы исследования
В 2008-2010 гг. проведено открытое, рандомизированное, сравнительное исследование по изучению эффективности и безопасности различных режимов дозирования комбинированного применения препарата ВИФЕРОН® при стационарном лечении детей раннего возраста с ОРИ. Критериями включения являлись: возраст – от 1 месяца до 3-х лет, нозологическая единица – ОРИ среднетяжелой формы, продолжительность заболевания на момент включения – не более 2 суток, отсутствие указаний на противовирусную и/или иммуномодирующую терапию, подписанное добровольное информированное согласие законного представителя ребенка. Всего в исследование был включен 91 ребенок (49 мальчиков и 42 девочки). Методом случайного распределения дети были рандомизированы на 3 группы. При этом в основной группе I (n=30) и в группе II (n=31), помимо базисного лечения, детям назначали комбинированную терапию Вифероном в разных режимах дозирования (табл. 1).
В основной группе I проводилась модифицированная интерферонотерапия: в течение первых 5 дней терапии ВИФЕРОН® использовали в виде ректальных суппозиторий (500000 МЕ 2 раза в сутки) в комбинации с эндоназальным введением мази (2500 МЕ 3-4 раза в сутки). В последующие 5 дней лечения переходили на более низкие дозы препарата. При этом ректально ВИФЕРОН® назначали по 150000 МЕ 2 раза в сутки, в то время как доза эндоназального введения препарата не изменялась и составляла 2500 МЕ 3-4 раз в сутки. Дети из основной группы II на протяжении всех 10 дней лечения получали ВИФЕРОН® (суппозитории) в стандартной дозе по 150000 МЕ (ректально) 2 раза в сутки и ВИФЕРОН® (мазь) по 2500 МЕ 3-4 раза (интраназально). В группе сравнения (n=30) использовали только базисную терапию (табл. 1).
Таблица 1.
Группы наблюдения и особенности проводимой терапии
|
Группы наблюдения |
Особенности терапии |
Режим дозирования и схема применения Виферона |
|
Основная группа I (n=30) |
ВИФЕРОН® (мазь)
+ ВИФЕРОН® (суппозитории)
+ Базисная терапия
|
ВИФЕРОН® (мазь):
2500 МЕ в каждый носовой ход 3-4 раза в сутки, ежедневно в течение 10 дней* + ВИФЕРОН® (суппозитории): в течение первых 5 дней 500000 МЕ (ректально) 2 раза в сутки, ежедневно; в течение 6-10 дня – 150000 МЕ (ректально) 2 раза в сутки, ежедневно
|
|
Основная группа II (n=31) |
ВИФЕРОН® (мазь)
+ ВИФЕРОН® (суппозитории)
+ Базисная терапия
|
ВИФЕРОН® (мазь):
2500 МЕ в каждый носовой ход 3-4 раза в сутки, ежедневно в течение 10 дней* + ВИФЕРОН® (суппозитории): 150000 МЕ (ректально) 2 раза в сутки, ежедневно в течение 10 дней
|
|
Группа сравнения (n=30) |
Базисная терапия |
– |
Примечание:
* — детям в возрасте до 2 лет мазь назначалась 3-х-кратно, от 2 до 3 лет – 4-х-кратно.
В специально разработанных индивидуальных картах наблюдения ежедневно регистрировали выраженность всех симптомов заболевания, фиксировали результаты лабораторных и инструментальных исследований, а также переносимость препаратов и наличие побочных явлений. Систему интерферона оценивали в динамике (до – и после окончания терапии) на основании определения ее параметров в сыворотке крови, а также в носоглоточных смывах. Концентрацию сывороточных ИФН-? и -? определяли методом твердофазного «сэндвич»-ИФА «ELISA», используя стандартные тест-системы «ИФА-БЕСТ» (ЗАО «Вектор-БЕСТ») Для определения индуцированной продукции ИФН in vitro использовали супернатанты. Индукцию ИФН-? осуществляли с помощью вируса болезни Ньюкасла (ВБН), штамм Канзас (концентрация – 1 ЦПЕ/мл), ИФН-? – фитогемагглютинина (концентрация 5 пкг/мл). Исследование интерферонового статуса проводили в отделе интерферона (руководитель – академик РАМН Ершов Ф.И.) ФГБУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздравсоцразвития России.
Статистическую обработку проводили на персональном компьютере с использованием пакета прикладных программ «Miсrosoft Exel 2007» и «Biostatica V 4.03» с вычислением средней арифметической (М) и ее стандартной ошибки (m). Статистическая значимость различий количественных признаков была оценена с использованием параметрических (t критерий Стьюдента) и непараметрических (серийный критерий, критерии Манна-Уитни и Вилкоксона) методов с учетом поправки Бонферрони при множественных сравнениях. Статистически значимыми считались отличия при pРезультаты и обсуждение
Изучение интерферонового статуса, проведенное в период разгара ОРИ, показало, что у большей части детей отмечался дефицит концентрации интерферонов в сыворотке крови и в назальных смывах. Так у 67,7±5,9% детей значения ИФН-? в сыворотке не отличались от нормативных у здоровых детей и находились за пределом чувствительности тест-систем (ниже 2 пкг/мл). Значительно реже определялись значения сывороточного ИФН-? в диапазоне от 2,0 до 5,0 пкг/мл – у 16,1±4,7% соответственно, р (рис. 1). Показатели, превышающие 5,0 пкг/мл и свидетельствующие, в условиях клинического разгара ОРИ, об адекватной реакции на вирусную агрессию отмечались в 16,1±4,7% случаев. Аналогичная ситуация была отмечена и при анализе показателей, характеризующих сывороточные концентрации ИФН-?. При этом низкие значения ИФН-? в сыворотке (ниже 2 пкг/мл) регистрировали в 4,8 раз чаще, чем значения в диапазоне от 2,0 до 10,0 пкг/мл и выше 10,0 пкг/мл, р (рис. 2). Выраженный дефицит ИФН-?, являющегося одним из главных медиаторов специфического гуморального ответа, подтверждает установленные нами ранее особенности онтогенеза системы интерферона [22]. Изучение индуцированной продукции интерферона также выявило, что в период разгара ОРИ у детей значительно чаще имеют место нарушения в системе ?-интерфероногенеза. Так, если низкий уровень продукции ИФН-? выявляли в 22,6±5,3%, то ИФН-? – у 40,3±6,2% обследованных (р). Анализ особенностей показателей интерферонового статуса в носоглоточных смывах показал поляризацию противовирусного ответа в сторону локального. Наряду с этим, такие же низкие показатели ИФН-? (r=0,09), то уровень ИФН-? имел умеренную прямую корреляцию с концентрацией сывороточного ИФН-? (r=0,46) (рис. 1, рис. 2).
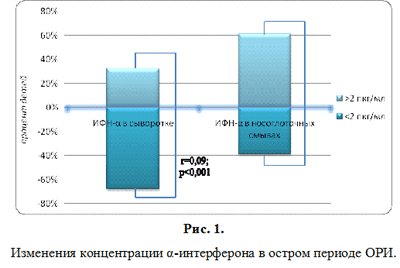
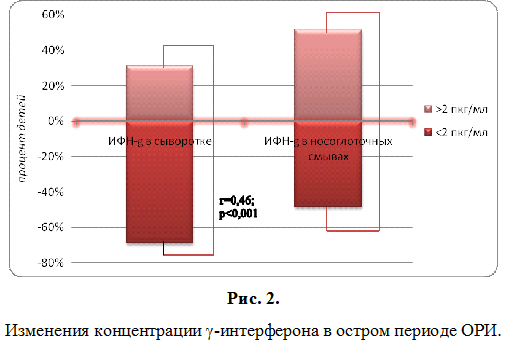
Таким образом, полученные результаты свидетельствовали, что у большинства обследованных детей раннего возраста с ОРИ имелись существенные сдвиги в функционировании системы ИФН. При этом изменения касались как содержания ИФН в сыворотке крови, так и их индуцированной продукции, отражающей функциональную активность и состояние компенсаторных возможностей. Снижение интерферонопродукции, преимущественно ИФН-?, возможно было связано как с возрастными особенностями ИФН-генеза, так и с истощением компенсаторных резервов в условиях рекуррентных инфекций. Кроме этого, были обнаружены низкие концентрации ИФН в носоглоточных смывах, что могло отражать недостаточность местной защиты слизистой носоглотки и способствовать длительной персистенции возбудителей, а также суперинфицированию. Выявленные нарушения в системе интерферона при ОРИ у детей раннего возраста, явились обоснованием для проведения ИФН-терапии, в качестве которой использовали препарат ВИФЕРОН®, являющийся генно-инженерным интерфероном альфа-2b.
ВИФЕРОН® назначали в соответствии с протоколом исследования, строго соблюдая схемы применения и режим дозирования (табл. 1). Динамика показателей интерферонового статуса до- и после лечения была оценена у большинства пациентов – у 62 детей (в основной группе I – 20 детей, в основной группе II – 21 ребенок, в группе сравнения – 21 ребенок). Клиническая оценка изменений выраженности симптомов заболевания, а также особенностей течения ОРИ была проведена у всех детей, включенных в исследование (n=91). Анализ полученных результатов показал, что применение Виферона характеризовалось положительным влиянием на показатели системы ИФН и способствовало более быстрой регрессии основных симптомов заболевания.
Показано, что в целом во всех группах имела место тенденция к повышению уровня сывороточного ИФН-?, независимо от способа терапии и по средним показателям составила в основной группе I 5,3±1,9 пкг/мл, в группе II 11,9±5,3 пкг/мл и группе сравнения 5,1±2,5 пкг/мл (р>0,05; р>0,05 по сравнению с группой сравнения соответственно). В то же время концентрация ИФН-? в сыворотке повышалось только в основной группе I и группе II (р>0,05). Особо следует отметить, что среди детей, не получавших ИФН-терапию, уровень сывороточного ИФН-? снижался в процессе наблюдения – 9,5±4,7 и 0,7±0,4 пкг/мл (р). Низкая ИФН-продуцирующая способность лейкоцитов, наблюдаемая нами в остром периоде заболевания, имела тенденцию к нормализации. При этом наибольшее влияние на индуцированную продукцию ИФН-? оказывала модифицированная ИФН-терапия, в сравнении со стандартной ИФН-терапией и базисным лечением, несмотря на отсутствие значимых различий (р>0,05).
Детальный анализ динамики показателей ИФН-статуса позволил выявить следующие позитивные особенности терапии Вифероном. Так, если в основной группе I к моменту окончания лечения число детей с исходно низкими значениями сывороточного ИФН-? уменьшилось в 1,5 раза (75,0±9,7% против 55,0±11,1%, р>0,05), то в группе сравнения только в 1,2 раза (71,4±9,9% против 61,9±10,6%, р>0,05). Отмечено также, что на фоне проведенной терапии Вифероном число детей с низкими показателями сывороточного ИФН-? сократилось в 1,2 раза (в основной группе I) или практически не изменилось (в основной группе II), в то время как группе сравнения у подавляющего большинства детей (95,2±4,7%) сохранялось значимое снижение ИФН-? в сыворотке, уровень которого находился ниже чувствительности тест-систем (р). Анализ показателей индуцированной продукции ИФН-? и ИФН-? у обследованных детей показал, что повышение уровня индуцированной продукции ИФН-? отмечалось чаще на фоне модифицированной схемы ИФН-терапии – 60,0±10,9%, по сравнению со стандартной ИФН-терапией – 38,0±10,6% (р>0,05) и с базисным лечением – 28,5±9,9% (рОтмечено также, что повышение способности к индуцированной продукции ИФН-? отмечалось чаще у детей основной группы I (у 55,0±11,1%), чем в группе II (39,1±10,6%, р>0,05) и группе сравнения (33,3±10,3%, р>0,05).
Особо следует отметить, что позитивное влияние комбинированной терапии Виферона на показатели интерферонового статуса, сопровождалось и значимым клиническим эффектом (табл. 2).
Таблица 2.
Продолжительность клинических симптомов ОРИ у детей раннего возраста в зависимости от проводимой терапии
|
Группы наблюдения |
n |
Продолжительность симптомов, в днях (М±m) |
||||
|
Лихорадка |
Интоксика-ция |
Затруднение носового дыхания |
Ринорея |
Гиперемия Зева |
||
| Основная I |
30 |
1,0±0,2 |
2,7±0,3* |
4,2±0,3* |
3,1±0,3 |
3,3±0,2* |
| Основная II |
31 |
1,3±0,3 |
2,5±0,2* |
4,5±0,3 |
2,9±0,4 |
3,4±0,2* |
| Сравнения |
30 |
2,1±0,4 |
3,8±0,4 |
5,4±0,4 |
3,9±0,4 |
4,9±0,4 |
Примечание:
* — рр) и 1,3±0,3 суток (р=0,06) (соответственно) против 2,1±0,4 суток в группе сравнения. Аналогичная динамика отмечена и при оценке проявлений синдрома интоксикации. Так, если основной группе I и в группе II длительность данного синдрома составляла 2,7±0,3 суток (р) и 2,5±0,2 суток (р) (соответственно), то в группе сравнения — 3,8±0,4 суток. Установлено, что комбинированное использование Виферона приводило к более быстрому купированию затрудненного носового дыхания (в основной группе I – 4,2±0,3 дня (р), в группе II — 4,6±0,3 дня (р=0,06) и 5,4±0,4 суток в группе сравнения). Анализ скорости регресса ринореи также свидетельствовал о позитивной тенденции снижения выраженности данного симптома у детей, получавших комбинированное лечение Вифероном. Так, если средняя продолжительность ринореи в основных группах I и II составила, соответственно 3,1±0,3 и 2,9±0,4 суток, то в группе сравнения – 3,9±0,4. Кроме этого установлено достоверно более быстрое купирование такого симптома воспаления верхних дыхательных путей, как гиперемия слизистых небных миндалин и глотки. При этом средняя продолжительность гиперемии зева в основных группах I и II составила, соответственно, 3,3±0,2 и 3,4±0,1 суток, в то время, как в группе сравнения – 4,9±0,4 суток (р).
При анализе зависимости продолжительности основных клинических симптомов ОРИ от характера изменений показателей индуцированной продукции ИФН-? и ИФН-? было выявлено, что повышение исходно сниженной способности к продукции как ИФН-?, так и ИФН–?, сопровождалось более быстрым регрессом клинических проявлений ОРИ в основной группе I. Проведенный корреляционный анализ выявил наличие обратной зависимости основных симптомов заболевания от уровня индуцированной продукции ИФН при повторном обследовании. Так, коэффициент корреляции между уровнем индуцированного ИФН-? и продолжительностью лихорадки составлял r = -0,32, интоксикации – r = -0,44 и выраженностью ринореи – r = -0,42. Полученные данные подтверждает, что повышение значений индуцированной продукции ИФН-? в более поздние сроки болезни ассоциируется с эффективным иммунным ответом против инфекционных патогенов и является признаком благоприятного течения и исхода ОРИ.
При этом особо следует подчеркнуть, что назначение Виферона позволяло существенно снизить госпитальное суперинфицирование и развитие осложнений. В целом установлено, что за время пребывания в стационаре у 46 детей (50,5%) отмечалось ухудшение состояния, проявляющееся повторной лихорадкой, интоксикацией и диарейным синдромом, что было расценено как развитие суперинфекции. При этом у детей основной группы I ухудшение состояния регистрировалось в 1,5 раза реже (23,9±6,3%), чем в группе II (37,1±7,1%, р>0,05) и 1,7 раз, чем в группе сравнения (39,1±7,2%, р>0,05). Особо следует подчеркнуть, что у детей, получавших ВИФЕРОН® в виде модифицированной схемы (основная группа I) суперинфекция протекала в легкой форме, а диарейный синдром продолжался в среднем 1,7±0,2 суток против 2,3±0,2 и 2,3±0,4 суток, в группах II и сравнения , соответственно, (р). Кроме этого установлено, что среди детей основных групп I и II не было зарегистрировано ни одного случая затяжного течения ОРИ, а также бактериального осложнения, в то время как у 10% детей группы сравнения требовалось подключение антибиотиков из-за развития бактериальных осложнений.
При оценке переносимости различных схем применения Виферона установлено, что, независимо от режима дозирования, использование препарата не сопровождалось развитием побочных эффектов и нежелательных явлений. В целом отмечена хорошая переносимость препарата, как при стандартной схеме применения, так и при модифицированном режиме дозирования
В заключение следует отметить, что анализ результатов проведенного исследования позволил установить – модифицированная виферонотерапия при ОРИ у детей раннего возраста оказывала позитивное влияние на показатели ИФН-статуса, что способствовало более быстрому регрессу основных клинических проявлений, снижало риск осложнений и госпитального суперинфицирования.
Таким образом, модифицированный способ лечения ОРИ у детей раннего возраста, основанный на применении стартовых доз рекомбинантного альфа 2b-интерферона – 500000 МЕ (ректально) в течение первых 5 дней, с переходом на 150000 МЕ в течение последующих 5 дней в комбинации с мазью Виферон (эндоназально), характеризуется хорошей переносимостью и высокой клинико-иммунологической эффективностью.
Литература:
1. О санитарно-эпидемиологической обстановке в Российской Федерации в 2009г. Государственный доклад. – М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. – 456 с
2. Острые респираторные заболевания у детей: лечение и профилактика/ Научно-практическая программа Союза педиатров России. – М.: Международный Фонд охраны здоровья матери и ребенка, 2002. – 69 с.
3. Шарапова О.В., Корсунский А.А. Инфекционные болезни у детей: прошлое, настоящее и будущее // Детские инфекции.–2003. – № 3. – С.4-6.
4. Щеплягина Л.А., Римарчук Г.В., Круглова И.В., Борисова О.И. Новые технологии в лечении острых респираторных заболеваний у детей // Лекции для врачей.– М. – 2009. – 28 с.
5. Самсыгина Г.А. Часто болеющие дети: проблемы патогенеза, диагностики и терапии // Педиатрия. – 2005. – №1. – С. 66-73.
6. Заплатников А.Л. Клинико-патогенетическое обоснование иммунотерапии и иммунопрофилактики вирусных и бактериальных заболеваний у детей: Автореф. дисс. … докт. мед. наук. – М. – 2003. – 48 с.
7. Ohmit S.E., and Monto A.S. Symptomatic predictors of influenza virus positivity in children during the influenza season // Clin Infect Dis. – 2006. – Vol. 43, № 5. – P. 564-568.
8. Red Book: 2008. Report of the Committee on Infection Diseases. 25rd: American Academy of Pediatrics, 2008.
9. Романцев М.Г., Горячева Л.Г., Коваленко А.Л. Противовирусные иммунотропные препараты в детской практике // Руководство для врачей. – Санкт-Петербург. – 2008. – 123 с.
10. Ройт. А., Бростофф Дж., Мейл Д. Иммунология: Пер. с англ. – М.: Мир. – 592 с.
11. Вельтищев Ю.Е. Становление и развитие иммунной системы у детей, иммунная недостаточность. Иммунодиатезы // Приложение к журналу Российский вестник перинатологии и педиатрии. Лекция для врачей №21. – М., 1998. – 79 с.
12. Образцова Е.В., Осидак Л.В., Афанасьева О.И., Головачева Е.Г., Милькинт К.К. и др. Препараты рекомбинантного интерферона ?-2 в лечении острых респираторных инфекций у детей // Детские инфекции. – 2005. – №2. – С. 46-50.
13. Ершов Ф.И., Григорян С.С., Орлов Т.Г., Мазанкова Л.Н. и др. Противовирусная терапия у детей // Детские инфекции.– 2006. – №3. – С. 56-60.
14. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы // М.ГЭОТАР–Медиа. – 2005. – 368 с.
15. Чеботарева Т.А., Мазанкова Л.Н., Малиновская В.В, Парфенов В.В, Ульянова И.И. Клинико-иммунологическая эффективность местной интерферонотерапии при ОРИ у детей // Вопросы практической педиатрии. – 2007. – №4. – С. 29-32.
16. Заплатников А.Л. Принципы рациональной терапии острых респираторных вирусных инфекций у детей раннего возраста // Русский медицинский журнал. – 2004. – Т. 12. – № 13. – С. 790-795.
17. Biron C.A. Interferons-?/? as immune regulators – a new look // Immunity. – 2001. – Vol. 14. – P. 661-664.
18. Hayden F.G., Albrecht J.K., Kaiser D.L., Gwaltney J.M. Jr. Prevention of natural colds by contact prophylaxis with intranasal alpha 2-interferon // Engl. J. Med. – 1986. – Vol. 314. – №2. – P. 71-75.
19. Макарова З.С., Доскин В.А., Малиновская В.В. Эффективность применения мази «Виферон» при реабилитации часто болеющих детей // Лечащий врач. – 2006. – №1. – С.86-87.
20. Макарова З.С., Доскин В.А., Малиновская В.В., Парфенов В.В. Применение «Виферона», мази для профилактики ОРВИ у детей // Детские инфекции. – 2007. – №1. – С.86-89.
21. Малиновская В.В., Деленян Н.В., Ариненко Р.Ю. Виферон – комплексный противовирусный и иммуномодулирующий препарат для детей и взрослых // Руководство для врачей. – М. – 2007. – 87с.
22. Ершов Ф.И., Малиновская В.В. Итоги и перспективы применения препаратов интерферона в инфекционной педиатрической практике. Вестник Академии мед. наук. – 1990. – №7. – С. 32-38.