Лечение ПВИ, в т.ч. генитальных кондилом, представляет в настоящее время определенные трудности, в связи с тем, что не существует определенных стандартов, зачастую лечение бывает неэффективным, с последующими рецидивами, стоимость лечения при запущенных формах заболевания оказывается высокой. Несмотря на то, что генитальные бородавки редко персистируют, а тем более увеличиваются в размере и количестве и обычно регрессируют спонтанно, выраженный онкогенный потенциал целого ряда типов ВПЧ, особенно в условиях иммуносупрессии, ставит проблему лечения генитальных бородавок в разряд весьма актуальных проблем современной медицины. Однако, проведено достаточное количество исследований по оценке эффективности того или иного метода.
Выбор метода лечения зависти от морфологии, размеров, количества и локализации высыпаний, возраста пациентов, а также опыта врача. Так, для лечения аногенитальных кондилом используют крио-, электро-, радио-, лазерную деструкцию, аргоноплазменную аблацию, обработку очагов поражения химическими и цитотоксическими лекарственными препаратами. Пациенты должны находиться под регулярным наблюдением у специалиста до полного исчезновения бородавок. К сожалению использование вышеуказанных методов в качестве монотерапии очень редко оказываются эффективными, характерной особенностью для папилломавирусной инфекции у детей является тот факт, что у них отмечается достоверное подавление способности лейкоцитов продуцировать альфа- и гамма-интерферон, что указывает на значительное снижение противовирусной защиты у детей с ПВИ по сравнению с группой здоровых детей [39], поэтому требуется комплексное лечение с использованием препаратов, оказывающих стимулирующее действие на активацию иммунной системы, местно или системно.
Неэффективность лечения или повторное появление элементов на тех же участках требуют смены метода лечения.
В лечении ПВИ у детей и подростков необходимо учитывать тот факт, что в 80% случаев инфекция протекает транзиторно. Нормальную цитологию без лечения к концу 1-го года наблюдения имеют 61%, к 3-му году – 91% пациенток, лишь у 3% пациенток отмечается прогрессирование в CIN III степени [26]. Поэтому тактика ведения девочек-подростков должна быть наблюдательной, а в случае выбора лечения необходимо использовать более щадящие методы с обязательным контролем эффективности.
Целью данной работы стала оценка эффективности комбинированной терапии с применением препарата Виферон® в лечении аногенитальных кондилом у девочек-подростков.
Материалы и методы исследования
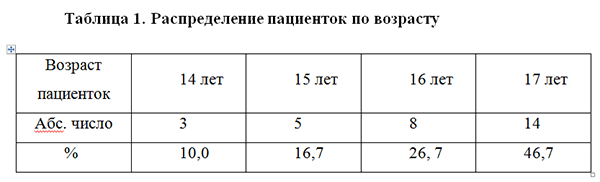
Нами было проведено комплексное обследование и лечение 30 девочек-подростков с аногенитальными кондиломами в возрасте от 14 до 17 лет.
Средний возраст пациенток составил 15,5 лет. Распределение пациенток по возрасту представлено в табл. 1.
Все пациентки были обследованы с целью определения инфицированности вирусом папилломы человека впервые с учетом предъявляемых жалоб: зуд в области наружных половых органов, патологические выделения из половых путей, образования аногенитальной области.
В работе использовались следующие методы обследования: общеклинический, ПЦР — диагностика в реальном времени для определения ДНК ВПЧ, с применением тест-системы «АмплиСенс» с выявлением типов высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого канцерогенного риска (6, 11), ПЦР диагностика урогенитальной инфекции, включая хламидии, микоплазмы, уреаплазмы, ВПГ, ЦМВ.
Для лечения использовалась комбинированная схема: комплексный препарат Виферон®, (состоящий из рекомбинантного альфа-2b интерферона и антиоксидантов (витамины Е и С)) по 500000 МЕ 2 раза в день, per rectum №10, а также гель Виферон® местно на область кондилом 2-3 раза в день длительностью 30 дней) в комбинации, при необходимости, с антибактериальными препаратами. После проведенной терапии 12 пациенткам (40,0%) проведена химическая деструкция кондилом препаратом солковагин. В 1 случае было необходимым применение хирургического лечения с помощью радиоволновой техники (Сургитрон).
Терапевтическое действие препарата Виферон® обеспечивается эффектами входящими в его состав рекомбинантного альфа-2b интерферона и всем комплексом компонентов препарата, активно дополняющих друг друга. Комплексный состав Виферон® обусловливает ряд эффектов: в сочетании с мембранно-стабилизирующими компонентами противовирусная активность рекомбинантного интерферона возрастает в 10-14 раз, усиливается его иммуномодулирующее действие на Т- и В- лимфоциты, нормализуется содержание иммуноглобулина Е, отсутствуют побочные эффекты. А взаимодействие компонентов препарата Виферон® позволяет значительно снизить дозы и продолжительность курсов антибиотикотерапии. Ректальное введение рекомбинантного ИФН позволяет достичь более высокой концентрации ИФН и более длительного его нахождения в крови, чем при парентеральных методах введения (В.В. Малиновская, 1998). Терапия Вифероном (500 000 МЕ интерферона альфа-2b) проводилась по схеме: ректально 1 свеча 2 раза в сутки, 10 дней. Параллельно проводилось топическое применение геля Виферон® (36 000 МЕ интерферона альфа-2b) 2 раза в сутки в течение 30 дней. Препарат наносится тонким слоем на кожу и слизистую наружных половых органов 2-3 раза в день, в результате чего формируется тонкая пленка, покрывающая пораженные участки, а также близлежащие здоровые ткани. Действие местного применения препарата позволяет исключить вероятное повторное инфицирование базальных слоев эпителия вирусом, а также блокирует сборку вирусных частиц в поверхностных слоях клеток.
В случае обнаружения сопутствующей микстинфекции, мы использовали антибактериальные препараты соответственно чувствительности к антибиотикам (комбинированный препарат полижинакс № 12 per vag., содержащий в своем составе полимиксин-В, нистатин и неомицин, а также макролиды или производные тетрациклина от 5 до 7 дней, per os).
Результаты исследования
Кондиломы наружных половых органов и влагалища определялись у всех пациенток, их количество и размеры варьировали – от единичных до множественных, от 0,3 до 1,5-2,0 см.
При генотипировании ВПЧ определялись следующие типы вирусов: 6, 11, 16, 18, 33, 45, 56, 49. Чаще всего мы определяли 2 и более типов вируса – у 83,3% (п=25) пациенток.
Доля пациенток, инфицированных низкоонкогенными типами вируса (6-й и 11-й) составила 36,7% (п=11), а высокоонкогенные типы (16-й, 18-й, 33-й, 45-й, 56-й, 49-й) определялись у 63,3% (п=19) девочек-подростков.
При проведении ПЦР-диагностики инфекций, передаваемых половым путем, было установлено: хламидиоз выявлен у 3,3% (п=1), микоплазмоз – у 13,3% (п=4), уреаплазмоз – 23,3% (п=7), кандидозный кольпит – 16,7% (п=5); бактериальный вагиноз выявлен у 63,3% (п=19) пациенток.
По результатам кольпоскопии нормальная кольпоскопическая картина определялась у 26,7% пациенток (п=8), эктопия шейки матки у 70,0% (п=21), атипическая кольпоскопическая картина была диагностирована соответственно у 73,3% (п=22), из них мозаика – у 68,2% (п=15), пунктация – у 45,5% (п=10), ацетобелый эпителий – у 77,3% (п=17).