И.С. Лутошкин 1, И.М. Османов 1, В.В. Длин 1, Е.А. Ружицкая 1, А.В. Новикова 2,
Ю.П. Резников 3, М.М. Минеев 3, О.В. Паршикова 4, Т.С. Гусева 4, В.В. Малиновская 4
1 Московский НИИ педиатрии и детской хирургии Росздрава,
2 Московскаямедицинская академия им И.М. Сеченова,
3 Центральная клиническая больница Медицинского центра Управления делами Президента РФ,
4 НИИ эпидемиологии и микробиологи им. Н.Ф. Гамалеи РАМН.
Представлены литературные данные о роли герпесвирусной инфекции в этиологии и патогенезе гломерулонефрита и новые подходы к его лечению. Представлено
обоснование использования в практике препаратов интерферона. Изложены собственные данные о частоте и структуре герпесной инфекции у детей с различными вариантами
гломерулонефрита. Представлена эффективность применения Виферона в комплексном лечении герпесассоциированного гломерулонефрита у детей.
Ключевые слова: дети гломерулонефрит, герпесвирус, виферон.
The resume:
Complex use of viferon in children with herpesassociated glomerulonephritis
I.S. Lutoshkin 1, I.M. Osmanov 1, V.V. Dlin 1, E.A. Rujzitskaya 1, A.V. Novikova 2, Y.P.Resnikov 3, M.M. Mineeva 3, O.V. Parshikova 4, T.S. Guseva 4, V.V. Malinovskaya 4
1 Moscow Research Institute of Pediatrics and Pediatric Surgery, Ministry of Health of the Russian Federation,
2 Moscow medical Sechenov academy,
3 Central clinical hospital of president medical center,
4 Scientific institute of epidemiology and microbiology.
The article describes the role of herpesviruses in etiology and pathogenesis of glomerulonephritis and modern methods of treatment. It presents information on the frequency and structure of
herpes infection and efficiency of application of viferon in complex treatment of herpesassociated glomerulonephritis in children.
Key words: children, glomerulonephritis, herpesvirus, viferon
Проблема гломерулонефрита у детей привлекает внимание исследователей в связи с большой распространенностью данного заболевания, часто прогрессирующим течением, ранней инвалидизацией и неблагоприятным прогнозом в плане развития терминальной стадии хронической почечной недостаточности [1, 2]. В последнее время значительно снизилась роль бактериальной инфекции, как основного этиологического фактора развития гломерулонефрита. По данным многих авторов большое значение в развитии и прогрессировании гломерулонефрита отводится различным вирусным инфекциям, в частности, вирусу гепатита В [3, 4]. Менее изучен вопрос о роли герпесвирусной инфекции в этиологии и патогенезе гломерулонефрита.
Интерес исследователей к данной инфекции связан с ее высокой распространенностью в человеческой популяции, а также способностью вирусов семейства Herpesviridae к персистенции в различных органах, тканях и клетках, включая почки и иммунокомпетентные формированию различных клетки.
Данное иммунопатологических обстоятельство процессов, способствует включающих иммунокомлексные и аутоиммунные реакции, вирусиндуцированные цитокиновые процессы в почечной ткани [5], приводя к прогрессированию заболевания и установлению прогностически неблагоприятных вариантов течения гломерулонефрита в отношении иммуносупрессивной терапии. Существуют единичные исследования по выявлению в иммунных комплексах антигенов вируса простого герпеса, цитомегаловируса и вируса Эпштейна-Барр [6-8], однако нет достаточных данных свидетельствующих о структуре и степени их инфицированности при различных клинико–морфологических вариантах гломерулонефрита. Недостаточно изучен также вопрос взаимосвязи вирусной персистенции с функционированием различных звеньев Т- и В- клеточного иммунитета у больных с гломерулонефритом и, прежде всего, субпопуляционного состава лимфоцитов, хелперно– супрессорных взаимоотношений и ряда других факторов. Кроме того, не ясны причины нарушений со стороны системы интерферона, которая, как известно, играет важную роль в противовирусной защите организма [9].
До настоящего времени не разработаны четкие варианты лечения гломерулонефрита, ассоциированного с персистирующей герпесвирусной инфекцией, так как на фоне иммуносупрессивной терапии нередко отмечается реактивация вирусной инфекции [10-12], что является существенным препятствием для проведения своевременной и адекватной терапии современными иммуносупрессантами. Таким образом, весьма актуальной является проблема изучения структуры и активности течения персистирующей герпесной инфекции у больных с гломерулонефритом. Не менее важным является выяснение вопроса о клинико– лабораторных, морфологических и иммунологических особенностях вирусассоциированного гломерулонефрита и о влиянии персистирующей и латентной герпесной инфекции на течение и прогноз гломерулонефрита. Все это обосновывает необходимость разработки современных комплексных методов лечения вирусассоциированных заболеваний почек у детей и, прежде всего, при гломерулонефрите. В литературе широко обсуждается проблема лечения герпесвирусной инфекции при различных иммуносупрессивных состояниях. Как известно, осложнения, вызываемые герпесвирусами при ослабленном иммунитете, имеют тяжелые последствия, приводя, в ряде случаев, к летальному исходу.
Показаниями к терапии герпесвирусных заболеваний являются:
вероятность активации присутствующих в организме человека герпесвирусов;
тяжелое, опасное для жизни острое или рецидивирующее герпесвирусное заболевание;
тяжелое течение острого или рецидивирующего герпесвирусного заболевания;
неблагоприятный фон, на котором возникла острая или рецидивирующая герпесвирусная инфекция [13].
По мнению большинства специалистов [11, 14] все разнообразие методов профилактики и лечения герпесвирусной инфекции, в конечном счете, сводится к трем главным подходам: иммунотерапии, химиотерапии, либо к комбинации этих способов. Целью иммунотерапии является воздействие на иммунитет. Мишенями иммунотерапии могут быть: системный иммунитет (т.е. вся совокупность механизмов иммунного ответа на генетически чужеродные антигены) и специфический противогерпетический иммунитет, а, кроме того — типоспецифический иммунитет к конкретным штаммам герпесвирусов [10].
ммунотерапия герпесвирусных заболеваний включает в себя терапевтическое использование интерферонов. Интерфероны — постоянный и естественный компонент противоинфекционной защиты человека. Они вырабатываются и хранятся во всех ядросодержащих клетках крови и эпителиоидных клетках слизистых. Сывороточный пул интерферонов в организме человека образован ?- (продуцируются в основном лейкоцитарными клетками), ?- (продуцируются, в основном, фиксированными в тканях макрофагами) и ?- (продуцируются лимфоцитами) молекулами. Механизм их противовирусного действия направлен на подавление сборки генетически чужеродных белков, входящих в состав оболочки, капсида и генома (РНК или ДНК) вирусов [15]. Интерфероны наиболее активны по отношению к размножающимся вирионам. В терапевтическом аспекте у них наиболее выражена профилактическая активность. Они могут сдерживать процесс размножения вирионов и несколько снижать концентрацию вирионов в крови и тканях [16].
При использовании интерферонотерапии отмечается иммуномодулирующий эффект, который заключается в усилении продукции всех видов эндогенного интерферона, нормализации соотношения Т-хелперов и супрессоров, увеличении продукции интерлейкина-1 и интерлейкина-2. Кроме того, имеют место антипролиферативный и противовирусный эффекты, которые наиболее выражены в отношении ряда вирусов, склонных к персистенции. Усиливая экспрессию антигенов комплекса HLA, интерфероны способствует усилению иммунного ответа на вирусные антигены, предотвращая тем самым развитие латентного состояния [3]. Работы отечественных свидетельствуют интерферонов о и терапевтически при герпесвирусной зарубежных правильной инфекции. авторов [17, тактике применения Они 18] широко убедительно препаратов применяются в трансплантологии, врожденных и приобретенных иммуносупрессивных состояниях, приводя к снижению репликативной функции вирусов и улучшению противовирусных свойств Т- и В- клеточных звеньев иммунитета. При использовании интерферона-? у больных после трансплантации почки, наблюдалось снижение содержания в крови цитомегаловируса и вируса Эпштейна-Барр, что уменьшало риск развития вирусассоциированных нефропатий и симптома отторжения органа [12].
В ряде случаев применение интерферонов и его индукторов обосновано при лечении вирусассоциированных гломерулонефритов, приводя к ремиссии заболевания или стабилизации процесса. В клинической практике наиболее часто используются нативные или рекомбинантные интерфероны, обладающие противовирусной, иммуномодулирующей и антилимфоцитарной активностью [19]. Имеются данные о применении интерферонов у больных с интерстициальным нефритом на фоне активной репликации вирусов. Использование противовирусных 5 препаратов в комплексе с патогенетической терапией приводило к улучшению по основному заболеванию [20]. Обосновано назначение интерферонов при тяжелых иммуносупрессивных состояниях, в частности в трансплантологии, которое приводило к снижению репликации вирусов, и минимизировало риск формирования лимфопролиферативных заболеваний и отторжения органа [21].
Таким образом, использование препаратов рекомбинанатного интерферона у детей с гломерулонефритом, ассоциированным с герпес-вирусной инфекцией является актуальным.
Цель работы: изучить частоту и структуру герпес-вирусной инфекции у детей с гломерулонефритом, эффективность протекающим Виферона в с нефротическим комплексной терапии синдромом, и оценить вирусассоциированного гломерулонефрита.
Пациенты и методы
Под наблюдением находилось 59 детей в возрасте от 6 до 16 лет, из них 26 с гормонорезистентным нефротическим синдромом — основная группа и 33 с гормоночувствительным нефротическим синдромом — группа сравнения. Все пациенты находились на обследовании и лечении в отделении наследственных и приобретенных болезней почек Московского НИИ педиатрии и детской хирургии Росздрава, в 2002?2005 годах.
Все дети поступали в стационар в плановом порядке. Из числа обследованных больных 46 пациентов находилось в активной стадии нефротического синдрома, 13 пациентов ? в стадии клинико?лабораторной ремиссии. Из 26 больных основной группы 23 ребенка обследовались на фоне приема иммуносупрессантов (q=0,89). Из 33 больных из группы сравнения преднизолон на момент обследования получали 18 детей (q=0,54).
Средний возраст детей и половой состав по группам достоверно не отличались.
Средняя длительность заболевания в основной группе была достоверно больше (р В качестве специальных методов исследования в работе применялись:
1. Методика определения антител классов IgM и G к вирусу простого герпеса 1 типа, цитомегаловирусу и вирусу Эпштейна-Барр в сыворотке крови методом иммуноферментного анализа. Определение антител основывалось на твердофазном двухстадийном непрямом иммуноферментном анализе, который базируется на способности биологического материала сорбироваться на поверхности специального пластика, используемого в качестве «твердой фазы». Исследуемая сыворотка расценивалась как положительная, если ее оптическая плотность превышала индекс пробы исследуемого контроля в два и более раз.
2. Методика определения вируса простого герпеса 1 типа, цитомегаловируса и вируса Эпштейна-Барр в мочевом осадке методом полимеразной цепной реакции. Для проведения полимеразной цепной реакции использовали стандартные методики амплификации, электрофореза и ультрафиолетовой трансиллюминации. Возбудитель присутствовал в пробе, когда электрофорезная светящаяся полоса находилась строго на уровне контрольного образца. Отсутствие полосы свидетельствовало об отсутствии данного возбудителя.
3. Методика цитомегаловируса, определения вируса антигенов вируса Эпштейна-Барр простого методом герпеса 1 типа, иммунофлюоресценции в морфобиоптатах почечной ткани. Для выявления вирусов применялся прямой и непрямой иммунофлюоресцентные методы с использованием сыворотки к мышиным антителам, меченой FITC, с последующей инкубацией и высушиванием на воздухе. Высушенные препараты исследовали в люминесцентном микроскопе ЛМ–79 (Россия) с длиной волны 750 нм. Результат считали положительным при наличии специфического (изумрудно- зеленого) свечения в структурах почечной ткани.
4. Методика определения интерферонового статуса. Определение интерферонового статуса проводилось по трем основным показателям: способности лейкоцитов продуцировать in vitro интерферон-?; способности лейкоцитов продуцировать in vitro интерферон-?; уровню циркулирующего в крови эндогенного (сывороточного) интерферона. Тесты проводили в стерильных 96-луночных круглодонных планшетах в трех повторах, с внесением различных индукторов, титрованием и инкубацией в течение суток. Учет результатов проводили через 24 часа инкубации при 37°С в атмосфере 5% СО2 с использованием инвертированного микроскопа.
5. Методика определения иммунологических показателей. Подсчет лейкоцитов проводили на автоматическом счетчике клеток «Coulter Counter» фирмы «Coultronics» (Франция).
Определение Т-лимфоцитов (CD3+) и их субпопуляций CD4+, CD8+, В- лимфоцитов (CD19+) проводили методом непрямой иммунофлюоресценции на проточном 7 цитометре с мониторинга использованием процесса соответствующих фагоцитоза моноклональных использовали метод антител. Для люминол-усиленной хемолюминисценции. Контроль проводили на люминесцентном фотометре «LKB-Wallaс 1251» (США). Митогенный ответ исследовали в реакции бласттрансформации лимфоцитов с использованием конканавалина А со стандартной средой RPMI 1640, по стандартной методике с помощью автоматического сборщика клеток «Dynatech» (Великобритания), и бета-счетчика «Rackbeta 1217» «LKB» (США). Уровень IgG-, IgА — содержащих циркулирующих иммунных комплексов определяли на спектрофотометре при длине волны 450 нм и концентрации полиэтиленгликоля 8,3% и 16%. IgG, IgА, IgМ в крови определяли методом нефелометрии c использованием стандартных антисывороток.
Результаты и обсуждение
Инфицированность (определение антител класса IgG в сыворотке крови методом иммуно-ферментного анализа) в основной группе и в группе сравнения была высокой и составляла в зависимости от типа вируса от (от 90% до 100%) (табл. 1.)
Таблица 1. Частота инфицированности герпесвирусами у детей основной группы и группы сравнения
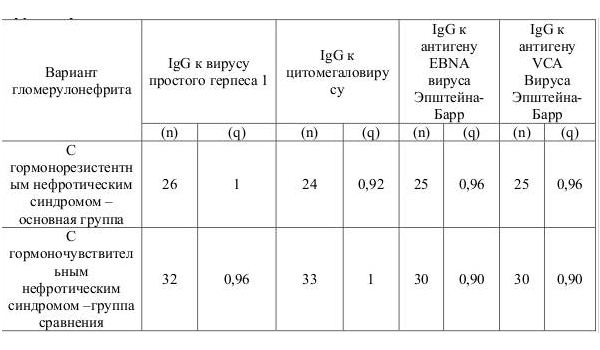
Для оценки частоты реактивированности герпесвирусной инфекции у детей в основной группе и группе сравнения проводили анализ IgM к вирусу простого герпеса и цитомегаловирусу, а также общего IgM к вирусу Эпштейна-Барр в сыворотке крови и репликацию вирусов в мочевом осадке методом полимеразной цепной реакции.
В основной группе (n=26) у 22 больных (q=0,84) наблюдалась реактивация одного или нескольких герпесвирусов (одновременное наличие в сыворотке крови IgG и IgМ). 8 Реактивация герпесвирусной инфекции в группе сравнения (n=33) наблюдалась лишь у 15 человек (q=0,45). У больных основной группы частота реактивированной герпесвирусной инфекции была достоверно выше (р
Рис. 1. Структура вирус-вирусных ассоциаций у детей основной группы
ВПГ – вирус простого герпеса, ВЭБ – вирус Эпштейна-Барр, ЦМВ – цитомегаловирус
У детей с гормоночувствительным нефротическим синдромом и реактивированной герпесвирусной инфекцией (n=15), у 46% больных отмечалась вирус-вирусная ассоциация, в основном в виде сочетания вируса простого герпеса и вируса Эпштейна- Барр (q=0,57). По всей видимости, наличие вирусных ассоциаций отражает некомпетентность противовирусной защиты и иммунной системы в целом, обусловленную как основным заболеванием, так и иммуносупрессивной терапией. 9 Суммируя результаты вирусологического обследования на наличие реактивированной герпесвирусной инфекции, в зависимости от клинической формы гломерулонефрита установлено, что в основной группе детей более характерным являлось наличие реактивированной инфекции вирусом Эпштейна-Барр (q=0,62), а также более высокой инфицированности тройными вирус-вирусными ассоциациями (q=0,25).
В то время как у детей с нефротической формы гломерулонефрита частота реактивированной герпесвирусной инфекции была почти в два раза ниже и характерно наличие двойных вирус-вирусных ассоциаций: вирус простого герпеса + цитомегаловирус (q=0,2) и вирус простого герпеса + вирус Эпштейна-Барр (q=0,3). При анализе клинико-лабораторных данных всех больных с моно персистирующей герпесвирусной инфекцией, характерным являлось наличие умеренной гематурии (q=0,25), минимальной лейкоцитурии (q=0,25), протеинурии в пределах от 1 до 3 г/сут (q=0,62). При вирусных ассоциациях отмечались более выраженные полостные и периферические отеки (q=0,33), у большего количества больных выявлялась умеренная гематурия и протеинурия более 3 г/сут (q=0,58).
Была изучена локализация и выраженность поражения почечных структур герпесвирусами у 22 детей основной группы. У 21 ребенка из 22 в различных отделах почечной ткани были обнаружены герпесвирусы. Установлено, что антигены вируса Эпштейна-Барр определялись в гломерулах у всех больных, как с нефротической, так и со смешанной формами гломерулонефрита. Канальцевая система наиболее часто поражалась вирусом Эпштейна-Барр при смешанной форме (q=0,88). Антигены вируса простого герпеса и цитомегаловируса – почти с одинаковой частотой определялись как в клубочках, так и в нефротелии, при смешанной форме гломерулонефрита, в то время как при нефротической форме гломерулонефрита только антигены вируса простого герпеса выявлялись в канальцевой системе. Таким образом, частота выявления герпесвирусных антигенов значительно выше при смешанной форме гломерулонефрита с преобладанием инфицированности вирусом Эпштейна-Барр. Установлена взаимосвязь между морфологической формой гломерулонефрита и преобладающим вариантом моно и вирус-вирусных ассоциаций (рис.2). При мембранопролиферативном гломерулонефрита преобладала моноинфекция вирусом Эпштейна-Барр или его сочетание с вирусом простого герпеса. При фокально-сегментарном гломерулосклерозе уменьшается доля моновирусной инфекции вирусом Эпштейна-Барр и отмечаются тройные вирус-вирусные ассоциации. При мезангио-пролиферативном гломерулонефрите у небольшой части детей отсутствуют антигены 10 вируса Эпштейна-Барр и более чем у половины детей определяется вирус простого герпеса.
Установлено, что при фокально-сегментарном гломерулосклерозе и мезангио- пролиферативном обнаруживались гломерулонефрите антигены вируса в канальцах Эпштейна-Барр и клубочках (q=0,68), а чаще при всего мембрано- пролиферативном гломерулонефрите – в равной степени антигены вируса простого герпеса и цитомегаловируса. Результаты иммуногистохимического исследования вирусных антигенов свидетельствуют о значительной степени инфицированности почечных структур вирусом Эпштейна-Барр независимо от морфологического варианта гломерулонефрита.
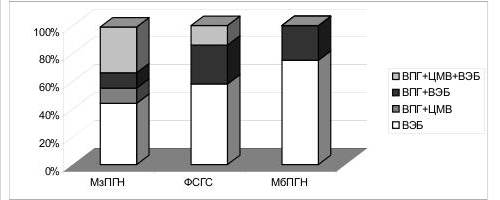
Рис. 2. Структура реактивированной герпесвирусной инфекции при различных морфологических вариантах гломерулонефрита
ВПГ – вирус простого герпеса, ВЭБ – вирус Эпштейна-Барр, ЦМВ – цитомегаловирус
Установлена связь между количеством лимфоцитов и их субпопуляций в зависимости от наличия реактивации герпесвирусов. У детей из основной группы на фоне реактивации герпесвирусной инфекции отмечались достоверно более выраженные (рТаблица 2. Изменение Т-клеточных показателей иммунитета у детей с гормонорезистентным и гормоночувствительным нефротическим синдромом, в зависимости от персистенции герпесвирусов
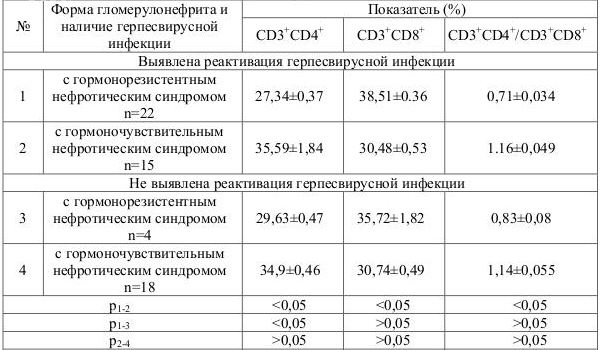
При сравнении показателей хелперно-супрессорных взаимоотношений в зависимости от реактивации одного или нескольких герпесвирусов установлено, что достоверно повышен уровень CD3+CD8+ в основной группе на фоне вирус-вирусной реактивации (р
Рис. 3. Эффективность противовирусной терапии по динамике частоты реактивированной герпесвирусной инфекции у детей с гормонорезистентным (ГРНС) и гормоночувствительным (ГЧНС) нефротическим синдромом (по данным полимеразной цепной реакции мочи)
Одним из показателей степени активности гломерулонефрита является выраженность протеинурии, причем ее степень выраженности и взаимосвязь с реактивацией вирусов имеет некоторые особенности. Так у детей с активно 14 размножающимися вирусами отмечалась тенденция к более высокой протеинурии по сравнению с группой детей, где вирусы находились в латентной стадии.
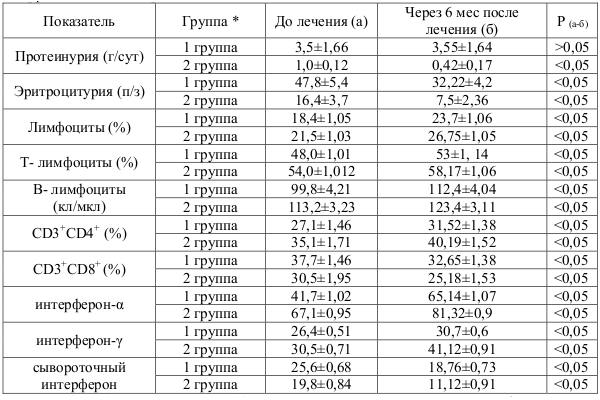
На фоне терапии валацикловиром, вифероном и иммуносупрессивной терапии определялось достоверно (рТаблица 3.Сводная таблица показателей эффективности терапии валацикловиром и вифероном у детей с гормонорезистентным и гормончувствительным нефротическим синдромом
Примечание *
– 1 группа (n=18) – дети с гормонорезистентным нефротическим синдромом пролеченные валацикловиром, вифероном и находящиеся на иммуносупрессивной терапии; 2 группа (n=10) – дети с гормоночувствительным пролеченные валацикловиром, вифероном и находящиеся на иммуносупрессивной терапии.
Оценивая эффективность применения специфической противовирусной терапии при вирусассоциированном гломерулонефрите установлено, что активное использование препаратов валацикловир и виферон в комбинации с иммуносупрессивной терапией оказывает положительный терапевтический эффект в виде снижения протеинурии и эритроцитурии, а также, улучшении показателей Т- и В-клеточных звеньев иммунитета и интерферонового статуса, что косвенно влияет на активность нефрита, понижает восприимчивость к оппортунистическим инфекциям и дает возможность применять современные схемы лечения гломерулонефрита.
Выводы
1. У детей с гломерулонефритом отмечается высокая частота встречаемости реактивированной герпесвирусной инфекции (64,5%), с наибольшей ее выраженностью при гормонорезистентном варианте нефротического синдрома (84%).
2. Ведущее место среди реактивированных вирусов семейства герпетиформных принадлежит вирусу Эпштейна-Барр, который встречался во всех вирус- вирусных ассоциациях, высокая частота которых наблюдалась как при гормонорезистентном, так и при гормоночувствительном вариантах нефротического синдрома. Одновременно с этим, у детей с различными морфологическими вариантами гломерулонефрита, отмечалось преобладание депонирования антигенов вируса Эпштейна- Барр в клубочках и канальцевом аппарате.
3. Оптимальным вариантом противовирусного лечения в комплексной терапии у детей с гормонорезистентным и гормоночувствительным вариантами нефротического синдрома, протекающих на фоне реактивированной герпесвирусной инфекции, является последовательное использование валацикловира и виферона, что способствует снижению репликации герпесвирусов (на 95,2%) и активности основного заболевания.
Литература
1. Соловьев А.А. Клинико-иммунологические и морфологические особенности хронического гломерулонефрита у детей: Автореф. дисс. …канд. мед. наук. СПб 1999; 43.
2. Прокопенко Е.И. Вирусные инфекции и трансплантация почки. Нефрол и диализ 2003; .5:.2: 108?116.
3. Длин В.В. Патогенетическое значение персистирующей вирусной инфекции при гломерулонефрите у детей и обосновании противовирусной и иммуномодулярной терапии: Автореф. дис. ….д-ра. мед. наук. М 1993; 542.
4. Rao K.V., et al. De novo immunotactoid glomerulopathy of the renal allograft: possible association with cytomegalovirus infection. Am J Kidney Dis 1994; 24: 97?103.
5. Rivolta E., Altschuler Y. Mechanisms of viral pathogenesis in rheumatic disease. Ann Rheum Dis 1999; 58: 454?461.
6. Toth T., Szucs S. Focal-segmental glomerulonephritis associated with herpes simplex encephalitis. Child Nephrol Urol 1988; 9: 3:173—175.
7. Mayer A.D., Dmitrewski J., Squifflet J.-P., et al. Multicenter randomized trial comparing tacrolimus (FK506) and cyclosporine in the prevention of renal allograft rejection: a report of the European Tacrolimus Multicenter Renal Study Group. Transplantat 1997; 64: 436?443.
8. Okada H., Suzuki H. et al. An atypical pattern of Epstein-Barr virus infection in a case with idiopathic tubulointerstitial nephritis. Nephron 2002; 92: 2: 440?444.
9. Kudoh A., Fukuda T.T,. et al. Reactivation of lytic replication from B cells latently infected with Epstein-Barr virus occurs with high S-phase cyclin-dependent kinase activity while inhibiting cellular DNA replication. J Virol 2003; 77: 2: 851?861.
10. Georgiev V., Yamaguchi H. Eds. Immunomodulating drugs. Proc N Y Acad Sci. 1993;1: 685.
11. Sakai Y., Ohga S., et al. Interferon-alpha therapy for chronic active Epstein-Barr virus infection Leuk Kes 1997; 21: 10: 941—950.
12. Cheeseman S.H., Henle W., et al. Epstein-Barr virus infection in renal transplant recipients. Effects of antithymocyte globulin and interferon. Ann Intern Med 1980; 93: 39—42.
13. Blohme I., Ahlmen J., et al. Disseminated herpes simplex infection: Primary lesions in urinary bladder and successful treatment with foscarnet sodium. Transplant Proc 1984; 16: 1672—1674.
14. Хахалии Л.Н. Успехи и проблемы современной терапии герпесвирусных инфекций. Южно — Российский медицинский журнал. 1998; 3: 32?38. 18
15. Allison A.C., Lafferty K. Eds. Immunosuppressive and anti-inflammatory drugs. Proc N Y Acad Sci 1993;1: 696.
16. Hadden J.W., Smith D.L. Immunopharmacology, immunomodulation, and immunotherapy. JAMA 1992; 268: 2964—2969.
17. Длин В.В., Шабалина Н.В., Горчакова Л.Н. Рекомбинантный a2-интерферон для профилактики рецидивирующей герпес-вирусной инфекции у детей с гломерулонефритом, получающих иммунодепрессивную терапию II Росс. нац. конгресс «Человек и лекарство». — М., 1995. — 309 с.
18. Hirsch M.S., Schooley R.T., et al. Effects of interferon-alpha on cytomegalovirus reactivation syndromes in renal-transplant recipients. N Engl J Med 1983; 308: 1489?1493.
19. Горчакова Л.Н. остропротекающего Роль герпес-вирусной гломерулонефрита и инфекции обоснование в прогрессировании использования альфа2- рекомбинантного интерферона. Автореф. дис. … канд. мед. наук. М 1999; 24.
20. Yu Z., Manickan E., Rouse B.T. Role of interferon-gamma in immunity to herpes simplex virus. J Leukoc Biol 1996; 60: 528—532.
21. Shapiro R.S., Chauvenet A., et al. Treatment of B-cell lymphoproliferative disorders with interferon alfa and intravenous gamma globulin. N Engl J Med 1988; 318: 1334.
Исмаил Магомедович Османов, доктор медицинских наук, заместитель директора по научной работе Московского НИИ педиатрии и детской хирургии Росздрава
Адрес для корреспонденции:
125412, Москва,
ул. Талдомская, д.2
Телефон: +7(495)484 58 02, +7(495)487 05 69 20




