И.Г. Солдатова, Е.Г. Гетия, Л.Л. Панкратьева, В.В. Омельяновский, М.В. Авксентьева, А.А. Кущ, Е.Н. Выжлова, Т.С. Гусева, О.В. Паршина, М.В. Дегтярева.
ГОУ ВПО Российский государственный медицинский университет им. Н.И.Пирогова.
ФГУ «НИИ вирусологии им. Д.И. Ивановского» Минздравсоцразвития России.
ФГБУ «НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи» Минздравсоцразвития России.
Проблема инфекционно-воспалительных заболеваний остается одной из наиболее актуальных в современной неонатологии, что обусловлено высокой частотой выявления данной патологии у новорожденных, склонностью к генерализации инфекционного процесса и высокими показателями летальности и тяжелой инвалидности у выживших [J. Rajaratnam, J. Marcus, A. Flaxman, H. Wang, A. Levin-Rector, L. Dwyer, M. Costa, A. Lopez, C. Murray. Neonatal, postneonatal, childhood, and under-5 mortality for 187 countries, 1970-2010: a systematic analysis of progress towards Millennium Development Goal 4. The Lancet, 2010; 375 (9730): 1988 — 2008]. Совершенствование способов терапии инфекционно-воспалительных заболеваний у новорожденных требует, прежде всего, углубленного изучения механизмов противоинфекционной защиты у данной категории пациентов. Анализ современной литературы свидетельствует о большом интересе исследователей к системе интерферона, которая играет важную роль как в осуществлении противовирусного иммунитета, так и в регуляции иммунного ответа при бактериальных и грибковых заболеваниях [O. Levy. Innate immunity of the newborn: basic mechanisms and clinical correlates. Nat Rev Immunol, 2007; 7(5): 379-90; G. Em?di, M. Just. Impaired interferon response of children with congenital cytomegalovirus disease. Acta Paediatrica, 2008; 63:183–187; K. Kelly-Scumpia, P. Scumpia, M. Delano, J. Weinstein, A. Cuenca, J. Wynn, L. Moldawer. Type I interferon signaling in hematopoietic cells is required for survival in mouse polymicrobial sepsis by regulating CXCL10. J Exp Med, 2010; 207(2):319-26; B. Kim, A. Shenoy, P. Kumar, R. Das, S. Tiwari, J. MacMicking. A family of IFN-gamma-inducible 65-kD GTPases protects against bacterial infection.. Science, 2011; 332(6030):717-21; F. van de Veerdonk, T. Plantinga, A. Hoischen. STAT1 Mutations in Autosomal Dominant Chronic Mucocutaneous Candidiasis.N Engl J Med, 2011; 365:54-61].
Биологическое действие интерферонов характеризуется универсальностью (интерфероны обладают высоким уровнем активности против целого ряда ДНК- и РНК-содержащих вирусов, синтетических двухцепочечных олигонуклеотидов и бактериальных эндотоксинов), длительным последействием (после удаления интерферона в обработанных клетках сохраняется способность подавлять размножение вирусов), дискретностью (интерфероны не чувствительны к антителам против микробных агентов, индуцирующих их выработку) [O. Haller, F. Weber. Review Pathogenic viruses: smart manipulators of the interferon system.Curr Top Microbiol Immunol, 2007; 316:315-34].
Разработка эффективной технологии производства фармацевтических препаратов генно-инженерных интерферонов открыла возможность применения данной категории лекарственных средств в широкой клинической практике, в том числе в неонатологии и педиатрии.
В последние годы в неонатологическую практику был внедрен препарат рекомбинантного интерферона-?2b человека- Виферон® (ООО «Ферон», г. Москва), в состав которого входит полипептид с молекулярной массой 18 кДа, полученный методом генной инженерии. В настоящее время Виферон® является единственным препаратом интерферона, разрешенным к применению у новорожденных детей в Российской Федерации, а производство данного препарата соответствует требованиям GMP (Сертификат соответствия требованиям Good Manufacturing Practice (GMP) №000063, выдан Национальным Контрольным органом – Государственным Научно-исследовательским институтом стандартизации и контроля за медико-биологическими препаратами имени Л.А.Тарасевича 15 июля 2009 года). Рекомбинантный интерферон-?2b идентичен природному лейкоцитарному интерферону, а антиоксиданты (токоферола ацетат и аскорбиновая кислота), входящие в состав препарата, пролонгируют эффект вводимого интерферона и нивелируют возможное негативное влияние на состояние паренхиматозных органов новорожденного ребенка. Препарат Виферон® представлен в форме ректального суппозитория с основой в виде масла какао. Введение интерферона ректально через геморроидальные вены в обход системы воротной вены позволяет достичь более высокой концентрации цитокина в сыворотке крови по сравнению с парентеральным способом введения и предотвратить быструю инактивацию препарата в ретикулоэндотелиальной системе печени. Доза препарата для новорожденных детей (100 000-150 000 МЕ/кг массы тела) была установлена на основании определения наилучшего иммунокорригирующего и интерферонкорригирующего эффекта in vitro в крови новорожденных детей с тяжелыми формами инфекционно-воспалительных заболеваний.
Цель исследования: провести анализ клинико-экономической эффективности применения иммуномодулирующего препарата рекомбинантного интерферона-?2b человека (Виферон®) в комплексной терапии внутриутробных инфекций.
Работа выполнена на кафедре неонатологии ФУВ (зав. кафедрой – д.м.н., профессор Дегтярева М.В.) Национального Исследовательского Университета ГОУ ВПО РГМУ Росздрава (ректор – академик РАМН, профессор Н.Н.Володин) в рамках приоритетного направления развития №3 «Профилактика, диагностика и лечение врожденных и перинатальных заболеваний у детей» за период с декабря 2006 года по июнь 2009 года. Наблюдение за новорождёнными детьми проводилось на базе отделений реанимации и интенсивной терапии новорожденных детей (ОРИТН) №1 (зав. отд. – к.м.н. Воронцова Ю.Н.) и №2 (зав. отд. – к.м.н. Бабак О.А.), отделений патологии новорожденных №1 (зав.отд. — к.м.н. Потапова О.В.) и №2 (зав.отд. — Миронюк О.В.) Городской Больницы №8 Департамента здравоохранения г. Москвы (главный врач – Дуленков А.Б.).
В исследование был включен 151 ребенок с осложненным течением неонатального периода. Всем детям в ОРИТН был поставлен диагноз внутриутробной инфекции по совокупности клинико-анамнестических, лабораторных и инструментальных данных. Были выделены 2 группы детей с внутриутробными инфекциями: основная группа (дети, получившие в составе стандартной базисной терапии препарат «Виферон»®, n=94) и группа сравнения (дети, получившие базисную стандартную комплексную терапию без дополнительной иммунокоррекции; n=57). В рамках данного проспективного наблюдения рандомизации не проводилось. Протокол исследования был одобрен Этическим Комитетом РГМУ.
На момент включения детей в исследование статистически значимых различий по массе и длине тела, гестационному возрасту, оценке по шкале Апгар на 1 и 5 минуте жизни (табл. 1), а также по основным клиническим параметрам (количеству очагов инфекции и их локализации) между основной группой и группой сравнения не выявлялось. Было показано, что в обеих группах не различалась базисная этиотропная и посиндромная терапия, было одинаковым количество детей, находящихся на искусственной вентиляции легких (ИВЛ), нуждавшихся в проведении полного парентерального питания. Между двумя группами не было выявлено различий по частоте применения других видов иммунотерапии, разрешенных к применению в неонатологии.
Таблица 1. Характеристика групп детей с внутриутробными инфекциями, получавших и не получавших препарат «Виферон»®
| Клинические параметры |
Дети, получившие терапию препаратом «Виферон»® (основная) (n =94) |
Дети, не получившие терапию препаратом «Виферон»® (группа сравнения) (n =57) |
р,U-test
|
|
Me [LQ; UQ] (min-max) |
Me [LQ; UQ] (min-max) |
||
| Гестационный возраст (недели) |
31 [28; 35] (25-41) |
30 [28; 32] (26-41) |
0,078 |
| Масса тела (граммы) |
1390 [1110; 2080] (650-4400) |
1305 [997,5; 1900] (450-3940) |
0,181 |
| Длина тела (см) |
40 [35; 45] (29-54) |
38 [35; 42] (25-53) |
0,124 |
| Окружность головы (см) |
29 [27;31] (23-26) |
28 [26;32] (20-37) |
0,30 |
| Окружность груди (см) |
25 [23;27] (20-35) |
24 [22;28] (15-35) |
0,532 |
| Оценка по шкале Апгар на 1 минуте жизни (баллы) |
6 [4; 7] (2-9) |
6 [4; 7] (0-8) |
0,764 |
| Оценка по шкале Апгар на 5 минуте жизни (баллы) |
7 [6; 7] (5-9) |
7 [6; 7] (0-9) |
0,539 |
В основной группе было 5 доношенных и 89 недоношенных новорожденных ребенка. Данные о массе и длине тела, оценке по шкале Апгар на 1-ой и 5-й минутах жизни детей представлены в табл. 1. По клинико-лабораторным признакам пневмония была диагностирована у 80 новорожденных детей (85,1%), некротизирующий энтероколит (НЭК) – у 50 детей (53,2%), менингоэнцефалит был документирован у 4 детей (4,3%), инфекция мочевыводящих путей отмечалась у 9 детей (9,6%), гнойный конъюнктивит — у 10 детей (10,6%), омфалит и флебит пупочной вены — у 6 детей (6,4%). Кандидоз кожи и слизистых оболочек был выявлен у 10 детей (10,6%).
Положительный результат обнаружения вируса простого герпеса (ВПГ) и/или цитомегаловируса (ЦМВ) в различных клинических материалах методом полимеразной цепной реакции (ПЦР) и быстрым культуральным методом (БКМ) был получен у 41 пациента (43,6%).
Из 94 детей 59 детей (62,8%) находились на ИВЛ, 27 детей (28,7%) получали респираторную поддержку при помощи назального СРАР, 8 детей (8,5%) оксигенировались дополнительно при помощи кислородной палатки.
Группу сравнения составили 4 доношенных и 53 недоношенных ребенка. Данные о массе и длине тела, оценке по шкале Апгар на 1-ой и 5-й минутах жизни детей представлены в табл. 1.
Пневмония была диагностирована у 55 новорожденных детей (96,4%), НЭК – у 25 детей (43,8%), менингоэнцефалит — у 1 ребенка (1,7%), инфекция мочевыводящих путей — у 5 детей (8,7%), гнойный конъюнктивит — у 5 детей (8,7%), омфалит и/или флебит пупочной вены — у 6 новорожденных (10,5%). Кандидоз кожи и слизистых оболочек был документирован у 6 детей данной группы (10,5%).
Положительный результат обнаружения вируса простого герпеса (ВПГ) и/или цитомегаловируса (ЦМВ) в различных клинических материалах методом полимеразной цепной реакции (ПЦР) и быстрым культуральным методом (БКМ) был получен у 27 пациентов (47,3%).
Учитывая выраженность клинических симптомов дыхательной недостаточности 34 из 57 детей (60%) находились на ИВЛ, 15 детей (27%) получал респираторную поддержку при помощи назального СРАР, 8 детей (13%) оксигенировались дополнительно при помощи кислородной палатки.
Нами был проведен тщательный сбор акушерско-гинекологического и соматического аннамнеза матерей наблюдаемых детей. Осуществлялось динамическое общеклиническое наблюдение за новорожденными детьми, базисное лабораторное обследование, в том числе общий анализ крови и мочи, биохимическое исследование крови, микроскопическое исследование спинномозговой жидкости, микробиологическое исследование посевов крови, ликвора, аспирата из трахеи, мочи. Для определения наличия инфекционно активного ЦМВ и ВПГ в моче, крови, слюне (или аспирате из трахеи в случае ИВЛ) и ликворе проводили быстрый культуральный метод в лаборатории клеточной инженерии ФГУ «НИИ вирусологии им. Д.И.Ивановского» Минздравсоцразвития России (зав. лабораторией – д.б.н., профессор Кущ А.А.). Выделение ДНК ВПГ и ЦМВ проводили методом полимеразной цепной реакции (качественный вариант). При постановке клинического диагноза учитывали также данные инструментальных методов исследования (рентгенография грудной клетки и брюшной полости, электрокардиография, ультразвуковое исследование органов брюшной полости и головного мозга).
Для достижения поставленной цели всем детям исследовали интерфероновый статус. Забор крови проводился в динамике в двух точках: в первые 14 суток жизни до начала терапии препаратом «Виферон»® (1 точка) и через 1 месяц после окончания иммунотерапии (2 точка). Интерфероновый статус исследовали культуральным методом, предложенным С.С.Григорян и Ф.И.Ершовым (1988), совместно с лабораторией онтогенеза и коррекции системы интерферона ФГБУ «НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи» Минздравсоцразвития России (зав. лабораторией – д.б.н., проф. В.В.Малиновская). Концентрации цитокинов ИФН-? и ИФН-? в сыворотке крови, величину спонтанной и индуцированной продукции данных цитокинов в культурах клеток крови новорожденных определяли методом твердофазного ИФА в системе бидетерминантного определения антигена (ELISA) с применением пероксидазы хрена в качестве индикаторного фермента. Для определения концентраций ИФН-? использовали тест-систему производства «Bender Medsystems» (Австрия), для тестирования концентраций ИФН-? применяли наборы реагентов Biosource (Бельгия), использовали ридер Anthos. В качестве индукторов использовали: для ИФН-? – вирус болезни Ньюкасла (ВБН), для ИФН-? — ФГА. Индекс стимуляции продукции эндогенных интерферонов рассчитывали как отношение показателя индуцированной продукции интерферона к показателю спонтанной продукции интерферона.
Для оценки экономической эффективности применения препарата «Виферон»® в комплексной терапии внутриутробных инфекций были рассчитаны прямые и косвенные затраты, ассоциированные с ведением пациентов в стационаре. Прямые затраты включали затраты на медикаментозную терапию, использование мягкого инвентаря, расходные материалы, затраты на кислород и заработную плату медицинского персонала. Косвенные затраты представлены недопроизведенным вкладом в ВВП по причине преждевременной смерти пациентов и инвалидизации вследствие заболевания, затратами государства на выплаты пенсий по инвалидности.
Статистическая обработка данных выполнялась с использованием пакета прикладных программ «Statistica 9.1» (StatSoft Inc., США). Количественные признаки описывались медианами и квартилями (Ме [LQ; UQ]). Качественные признаки описывались абсолютными и относительными частотами их значений. Для количественных признаков сравнение в несвязанных группах проводилось с использованием непараметрического теста Манна-Уитни (U-test), сравнение в связанных группах проводилось с использованием непараметрического теста Вилкоксона (Wilcoxon matched pairs test; W-test). Для сравнения частот значений признаков в группах применялся двухсторонний точный критерий Фишера (ТКФ). Для оценки эффективности вмешательства рассчитывался показатель относительного риска (Relative Risk- RR) и индекс NNT (Number Needed to Treat = число пациентов, которых необходимо пролечить для предотвращения одного летального исхода) с помощью пакета прикладных программ «MedCalc Pro. Evidence-based medicine. 2.2.2» (Mathias Tschopp & Pascal Pfiffner, США). Различия считались статистически значимыми при достигнутом уровне значимости ррезультаты.
В данном проспективном исследовании показанием к назначению препарата «Виферон»® детям являлось тяжелое течение внутриутробной инфекции. Препарат «Виферон»® вводили ректально по 1 свече, содержащей 150 000 МЕ рекомбинантного интерферона-?2b человека, каждые 12 часов в течение 7 дней в сочетании со тандартной базисной комплексной терапией.
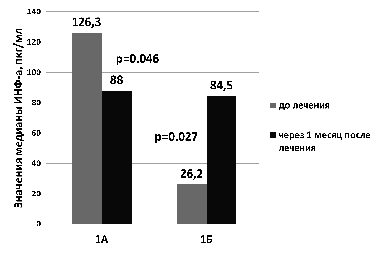
Показатели спонтанной продукции интерферонов и их концентрации в сыворотке крови приближались к порогу чувствительности тест-систем и значимо не различались у детей 1-й и 2-й групп. В связи с высокой вариабельностью значений индуцированной продукции ИФН-? и ИНФ-? дети с внутриутробной инфекцией были разделены на две подгруппы: в первую подгруппу были включены дети с высоким исходным показателем индуцированной продукции ИНФ-? (>62,4 [Me] пг/мл, n=31- подгруппа 1А, n=20- подгруппа 2А) и ИНФ-? (>12,2 [Me] пг/мл, n=30- подгруппа 1А, n=17- подгруппа 2А), во вторую подгруппу – дети с исходно низким показателем индуцированной продукции ИНФ-? (Рисунок 1. Изменение показателя индуцированной продукции ИФН-? у недоношенных детей с врожденной инфекцией в результате лечения с применением препарата «Виферон»® в зависимости от исходного уровня индуцированной продукции ИФН-?
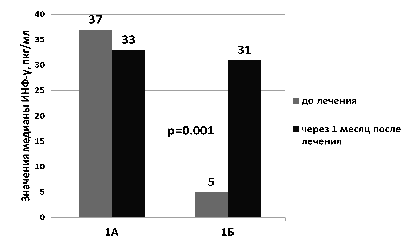
У детей с исходно низким показателем индуцированной продукции ИНФ-? (подгруппа 1Б) после лечения препаратом «Виферон»® показатель индуцированной продукции ИНФ-? статистически значимо возрастал (медианы 5 пг/мл и 31 пг/мл, соответственно, p=0,001, W-test). У детей с исходно высоким показателем индуцированного ИНФ-? (подгруппа 1А) после терапии этот показатель значимо не изменялся (p=0,75; W-test) (рис. 2). У детей, не получавших препарат «Виферон»® в составе комплексной терапии, в динамике не происходило значимых изменений показателя индуцированной продукции ИФН-?. Полученные данные свидетельствуют об иммуномодулирующем действии препарата «Виферон»®, которое выражается в разнонаправленном изменении уровней индуцированной продукции ИФН-? и ИНФ-? лейкоцитами недоношенных детей с ВУИ в зависимости от величины исходного уровня продукции эндогенных интерферонов.
Рисунок 2. Изменение показателя индуцированной продукции ИФН-? у недоношенных детей с клиническими признаками врожденной инфекции в результате базового лечения с применением препарата «Виферон»®
При расчете индекса стимуляции продукции ИНФ-? лейкоцитами периферической крови до и после применения в составе комплексной терапии препарата «Виферон»® было выявлено статистически значимое увеличение данного параметра оценки интерферонового статуса. У детей, не получивших препарат «Виферон»®, в динамике не происходило значимых изменений индекса стимуляции продукции ИНФ-?. У новорожденных с исходно высокими уровнями индуцированной продукции ИНФ-? индекс стимуляции продукции ИНФ-? в динамике снижался вне зависимости от факта включения в комплексную терапию иммуномодулирующего препарата «Виферон»® (Табл.2).
Таблица 2. Сравнение индекса стимуляции продукции ИФН-? до и после применения препарата «Виферон»®
| Группы детей |
Индекс стимуляции |
p (W-test) |
|
|
1-я точка исследования (до лечения ) |
2-я точка исследования (после лечения) |
||
| Дети с исходно низкими уровнями цитокина, получившие препарат «Виферон»® |
2,5 [1,5;6,9]
|
17 [3,4;21]
|
0,02 |
| Дети с исходно низкими уровнями цитокина, не получившие препарат «Виферон»® |
3,4 [1;6]
|
3,4 [1;8]
|
0,9 |
| Дети с исходно высокими уровнями цитокина, получившие препарат «Виферон»® |
25 [21;37]
|
11,4 [8,8;2] 2 |
0,003 |
| Дети с исходно низкими уровнями цитокина, не получившие препарат «Виферон»® |
34,5 [17;80]
|
15,4 [5,4;42,7]
|
0,006 |
При сравнении патологической симптоматики и нозологических форм заболеваний, их тяжести и исходов у детей, получавших и не получавших препарат «Виферон»®, было получено статистически значимое различие по частоте формирования бронхолегочной дисплазии и тяжелых форм ретинопатии недоношенных (табл. 3).
Таблица 3.
Частота развития бронхолегочной дисплазии и тяжелых форм ретинопатии недоношенных у детей с клиническими признаками внутриутробной инфекции, получавших и не получавших терапию препаратом «Виферон»®
|
Диагноз |
Основная группа с препаратом «Виферон»® |
Группа сравнения без препарата «Виферон»® |
р (ТКФ) |
|
Бронхолегочная дисплазия (БЛД) |
16/94 17% |
18/57 31,53% |
0,04 |
|
OR 0,444 95% CI [0,205; 0,965] RR 0,539 95% CI [0,3; 0,97] |
|||
|
Задняя агрессивная ретинопатия недоношенных среди детей с РН |
1/35 2,8% |
4/19 21% |
0,04 |
|
OR 0,11 95% CI [0,011; 1,072] RR 0,136 95% CI [0,016; 1,129] |
|||
В соответствии с международными критериями оценки выживаемости при исследовании эффективности препаратов в клинической практике учитывали летальность в течение 28 суток, следующих за назначением препарата «Виферон»® (табл. 4).
Таблица 4.
Сравнение показателей летальности у детей с врожденной инфекцией, получавших и не получавших терапию препаратом «Виферон»®
|
Диагноз |
Основная группа с препаратом «Виферон»® |
Группа сравнения без препарата «Виферон»® |
р (ТКФ) |
|
ВУИ |
4/94 (4,2%) |
10/57 (17,5%) |
0,009 |
| OR = 0,21 95% CI [0,05 — 0,67] NNT=8 95% CI [4; 29]
RR = 0,26 95% CI [0,07 — 0,69] |
|||
|
Некротизирующий энтероколит (НЭК) |
3/50 (6%) |
7/25 (28%) |
0,01 |
| OR = 0,15 95% CI [0,017 – 0,716] NNT=5 95% CI [2; 20]
RR = 0,21 95% CI [0,03 – 0,741] |
|||
|
Пневмония |
2/84 (2,3%) |
10/55 (18%) |
0,002 |
| OR = 0,12 95% CI [0,015 – 0,615] NNT=7 95% CI [4; 17]
RR = 0,11 95% CI [0,019 – 0,65] |
|||
Показатель летальности в основной группе составил 4,2% (4/94), а в группе сравнения – 17,5% (10/57) (р=0,009, ТКФ). Среди детей, у которых был диагностирован НЭК, умерло 3 детей из 50, получивших препарат «Виферон»®, и 7 из 25 детей группы сравнения (6% против 28%, соответственно; р=0,01, ТКФ). Среди детей, перенесших внутриутробную пневмонию, умерли 2 детей из 84 получавших «Виферон»® (2,3%) и 10 из 55 детей группы сравнения (18%) (р=0,002, ТКФ). Было установлено, что у 13 из 14 умерших детей (4 умерших ребенка основной группы и 9 умерших детей группы сравнения) отмечались низкие уровни индуцированной продукции ИНФ-? и ИНФ-?. Для предотвращения одного случая летального исхода необходимо провести иммунотерапию препаратом «Виферон»® 8 пациентам с внутриутробной инфекцией.
Нами был проведен расчет стоимости лечения детей с внутриутробными инфекциями в зависимости от наличия или отсутствия факта включения в комплексную терапию иммуномодулирующего препарата Виферон® (Табл.5). Средняя длительность пребывания детей основной группы в ОРИТН составила 18 [13;20] дней, в отделении патологии недоношенных (ОПН) — 23 [14;45] дня. Средняя длительность пребывания детей из группы контроля в ОРИТН составила 32 [18;37] дня, в ОПН — 39 [27;61] дней.
Таблица 5.
Стоимость лечения новорожденных детей с внутриутробной инфекцией в зависимости от включения в комплексную терапию препарата Виферон ®.
|
Патология |
Препарат |
Стоимость базисной терапии (руб.) |
Стоимость препарата Виферон® на курс (руб.) |
Общая стоимость терапии (руб.) |
Стоимость терапии в ОРИТН (руб.) |
Стоимость терапии в ОПН (руб.) |
|
ВУИ |
Виферон® |
81 975,67 |
363,81 |
82 339,48 |
52 904,85 |
29 070,82 |
|
Базисная |
100 824,4 |
0 |
100 824,4 |
67 600,64 |
33 223,8 |
Было продемонстрировано, что включение иммуномодулирующего препарата рекомбинантного интерферона-?2b человека (Виферон®) в комплексную терапию внутриутробных инфекций позволяет сократить затраты на лечение новорожденного ребенка в условиях стационара, а также суммарные затраты на госпитализацию новорожденного ребенка с внутриутробной инфекцией в целом с 341 966 рублей до 272 073 рублей на одного пациента.
Кроме того, мы оценили социально-экономический ущерб от внутриутробных инфекций с учетом прямых и косвенных затрат в зависимости от наличия или отсутствия включения в комплексную терапию препарата Виферон® (Табл.6).
Таблица 6.
Экономический ущерб от внутриутробных инфекций в зависимости от включения в комплексную терапию препарата Виферон®
|
Параметр
|
Терапия |
|
|
Виферон |
Базовая |
|
| Стоимость стационарного лечения (руб.) |
272 073 |
341 966 |
| Затраты на выплату пенсий по инвалидности (руб.) |
588 829 |
588 829 |
| Недопроизведенный вклад в ВВП (руб.) |
1 441 454 |
4 141 433 |
| Сумма затрат (руб.) |
2 302 356 |
5 072 228 |
| Размер предотвращенного ущерба (руб.) |
2 769 872 |
0 |
Нами было показано, что предотвращенный ущерб от внутриутробных инфекций с учетом прямых затрат и косвенных потерь в случае включения в комплексную терапию препарата Виферон® составляет 2 769 872 рубля на одного пациента, что позволяет расценивать иммуномодулирующую терапию препаратом рекомбинантного интерферона ?2b человека как затратно-сберегающую технологию, позволяющую эффективно снизить показатель летальности и число инвалидизирующих осложнений неонатального периода.
На основании полученных результатов мы сделали следующие выводы. Включение препарата рекомбинантного интерферона-?2b человека (Виферон®) в состав комплексной терапии внутриутробных инфекций способствует модулирующему влиянию на величину индуцированной продукции ИФН-? и ИНФ-? лейкоцитами недоношенных детей, статистически значимо снижает показатель летальности, частоту возникновения бронхолегочной дисплазии и тяжелых форм ретинопатии недоношенных детей. Высокий уровень предотвращенного ущерба от внутриутробных инфекций при включении в состав комплексной терапии препарата Виферон® позволяет рекомендовать данный вид иммунотерапии для широкого клинического применения в неонатологии.