Громадина О.В., Локшина Э.Э., Зайцева О.В., Дмитриева Е.В., Малиновская В.В., Шкляева И.В., Гусева Т.С., Паршина О.В., Парфенов В.В.
ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва,
ГУ НИИ Эпидемиологии и Микробиологии им. Н.Ф. Гамалеи РАМН, Москва.
Summary. Background. To study clinical importance of indicators of innate immunity in children with reccurent wheezing and the effectiveness of recombinant interferon ?2b (Viferon, Russia) in complex treatment. Methods. 187 children with reccurent wheezing and 16 healthy children were included in this study aged from 1 to 10 years. It was investigated the level of eosinophilia, total IgE, level of subpopulations of blood lymphocytes, immunoregulation index, the expression levels of TLR-2 and TLR-4 on the surface of monocytes, the percentage of proinflammatory monocytes, and also evaluated the effectiveness of therapy. Results. We revealed increase of natural killers, proinflammatory monocytes, eosinophils, with increased expression of TLR2, which is in inverse proportion to the frequency of the ARI in children with reccurent wheezing. After treatment of Viferon we revealed reduction ARIs, decrease of episodes and duration of wheezing in children. Conclusion. Revealed changes of innate immunity and the reduction of activity indicators of adaptive management showed signs of deficiency of the immune system in the group of children with recurrent wheezing. Using of interferon alfa-2b in the complex therapy of children with reccurent wheezing has a positive therapeutic and protective effect.
Введение
Острые респираторные инфекции (ОРИ) у детей занимают ведущее положение в структуре детских инфекционных болезней, где их доля составляет около 80% [1, 2]. Одной их наиболее распространенных форм ОРИ у детей являются бронхиты, которые по данным разных исследователей составляют от 15 до 50%. [3-7]. У пациентов, относящихся к группе часто и длительно болеющих, частота бронхитов увеличивается до 50-90%, преимущественно в виде бронхообструктивного синдрома (БОС) [8]. Согласно данным, представленным в национальной программе по диагностике, лечению и профилактике бронхиальной астмы, каждый четвертый ребенок переносит хотя бы один эпизод бронхиальной обструкции в возрасте до 6 лет [9]. Не смотря на достигнутые успехи в диагностике и лечении заболеваний органов дыхания, сохраняется тенденция к увеличению числа детей с рецидивирующим БОС [1,10-13]. Необходимо отметить, что в 1/3 случаев рецидивирующий БОС является проявлением бронхиальной астмы, и требует раннего назначения адекватной терапии [11].
Предрасполагающими факторами к рецидивирующему характеру бронхиальной обструкции на фоне ОРИ у детей являются анатомо-физиологические особенности дыхательного тракта (преобладание бронхов мелкого калибра, склонность к отеку их слизистой, гиперсекреция и изменение вязко-эластических свойств мокроты) и особенности реагирования иммунной системы (Th2 направленность иммунного ответа, несостоятельность макрофагально-фагоцитарного звена, интерфероногенеза, снижение концентрации компонентов комплемента при альтернативном пути воспаления и продукции иммуноглобулинов (Ig) классов A и G, а также незрелость Т- и В-лимфоцитов [1,11,14]).
В последние годы значительно расширились представления о роли эффекторов врожденного иммунитета в защитных реакциях организма, что связано с открытием семейства Toll-like рецепторов (TLR) [15]. В настоящее время система TLR рассматривается как первая линия защиты организма против микробной инвазии [16]. TLR распознают бесчисленное разнообразие патогенов по наличию определенных консервативных структур, в том числе липополисахарида – основного компонента клеточной стенки грамотрицательных бактерий.
Известно, что семейство TLR представлено 13 членами, каждый из которых связывается с определенным типом консервативных структур патогенов. В частности, TLR4 является рецептором к ЛПС, и в этой связи играет решающую роль в ответе организма на инфекцию, обусловленную грам-отрицательными бактериями; TLR3 активируется двухспиральной РНК – промежуточным продуктом репликации вируса. При взаимодействии TLR со специфическими лигандами происходит активация внутриклеточного пути передачи сигнала с мобилизацией ядерных факторов транскрипции (NF-kappa-B, IRF), и в конечном итоге экспрессия генов провоспалительных цитокинов и интерферонов I типа [17]. Элементы врожденного иммунитета являются необходимым связующим звеном для запуска адаптивного иммунитета.
Целью нашей работы явилось изучение клинической значимости показателей врожденного иммунитета с оценкой экспрессии TLR2 и TLR4 в сопоставлении с характеристиками адаптивного иммунитета у детей с рецидивирующим БОС на фоне ОРИ, в том числе у детей с бронхиальной астмой, а также изучение клинической эффективности рекомбинантного интерферона ?2b (Виферон ®, Россия) в комплексной терапии данной группы пациентов.
Материалы и методы. Работа была выполнена на кафедре педиатрии ГБОУ ВПО МГМСУ им. АИ Евдокимова Минздрава России (зав. кафедрой – д.м.н., проф. О.В. Зайцева) в период с ноября 2007 года по март 2010 года. Клиническая часть работы была проведена на базе Детской городской клинической больницы Святого Владимира (главный врач — д.м.н., проф. Д.Ю. Выборнов), исследование иммунологического статуса — в лаборатории онтогенеза и коррекции системы интерферонов ГУ НИИ Эпидемиологии и Микробиологии им. Н.Ф. Гамалеи РАМН (руководитель — проф. Малиновская В.В.).
Дизайн исследования: пострегистрационное открытое проспективное исследование (фаза IV) в параллельных группах.
Под нашим наблюдением находилось 187 детей с рецидивирующим БОС, протекавшим на фоне ОРИ (не менее 3 эпизодов бронхообструкции) в возрасте от 1 до 10 лет. У 31 из них (16,6%) диагностировано течение бронхиальной астмы. В исследование была включена контрольная группа здоровых детей (n=16) без признаков хронических и острых воспалительных заболеваний.
Всем детям было проведено общеклиническое обследование, включающее оценку анамнеза, данные клинического осмотра, результаты лабораторных методов исследований (клинического анализа крови, определение общего IgE). Общий IgЕ определяли в сыворотке крови методом иммуноферментного анализа (ИФА) на анализаторе АИФР-01 «Униплан» (Россия) по стандартной методике.
Иммунологическое исследование включало определение в сыворотке крови субпопуляций лимфоцитов периферической крови (CD3+, CD3+CD4+, CD3+CD8+, CD3-CD19+, CD3-CD16+56+, CD3-CD8+,) индекса иммунорегуляции, уровней экспрессии Толл-подобных рецепторов (TLR-2, TLR-4) на поверхности моноцитов и процентное содержание провоспалительных моноцитов (CD14+CD16+).
Для иммунофенотипического исследования лейкоцитов использовалась цельная венозная кровь, собранная в пробирки с К3ЭДТА. На двухлазерном проточном цитофлуориметре FACSCalibur (Becton Dickinson, США) с использованием 4-х-цветной панели антител MultiTEST IMK Kit (Becton Dickinson) исследовали основные субпопуляции лимфоцитов. Для определения субпопуляции CD14+CD16+-провоспалительных моноцитов использовали мышиные моноклональные антитела производства фирмы Becton Dickinson CD14-PerCP, CD16-PE, анти-HLА-DR-APC. Оценку степени экспрессии поверхностных маркеров TLR-2, TLR-4 на моноцитах проводили с использованием мышиных моноклональных антител к человеческим антигенам производства фирмы Becton Dickinson анти-CD14-PerCP, анти-HLА-DR-APC и фирмы eBioscience к антигенам TLR-2-FITC (CD282), TLR-4-PE (CD284). Гейтирование популяции моноцитов проводили на основании экспрессии CD14 и бокового светорассеяния (SSC). Для оценки степени экспрессии молекул TLR-2 и TLR-4 использовали разницу интенсивности флуоресценции клеток rMFI (relative mean fluorescence intensity) при связывании со специфическими моноклональными антителами и изотипическим контролем.
Статистическая обработка результатов проводилась общепринятыми методами с помощью компьютерных программ Microsoft Exсel-97 (Microsoft, США) и Statistica 7 (StatSoft Inc., США), в том числе с использованием непараметрических критериев статистической значимости различий двух выборок. Для оценки наличия или отсутствия связей между группами различных показателей проводился корреляционный анализ с использованием коэффициента ранговой корреляции Спирмена и Пирсона.
Результаты и обсуждение
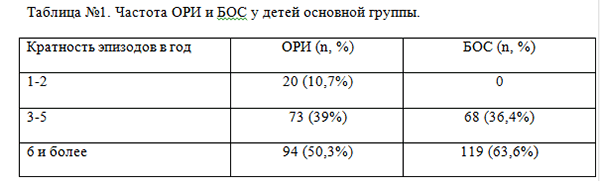
Все пациенты основной группы имели схожую клиническую картину ОРИ, протекавших с проявлениями БОС, преимущественно среднетяжелого течения (95,2% — 178 детей). Среди обследуемых пациентов преобладали дети с высокой частотой ОРИ (более 6 раз в год), что позволило отнести их к группе часто и длительно болеющих детей (ЧБД). У всех детей отмечалась высокая кратность эпизодов БОС (таблица №1). В анамнезе у большинства обследованных пациентов начало БОС, и его рецидивирование было сопряжено с проявлениями острой респираторной инфекции. ОРИ на первом году жизни перенесли 75,6% (n=62) детей основной группы. При этом манифестация ОРИ происходила в течение первых 3-х месяцев жизни практически у половины пациентов с рецидивирующим БОС (таблица№1).
В основной группе у наблюдаемых детей были выявлены различные аллергические заболевания. Так, у 16% (n=18) детей была впервые диагностирована бронхиальная астма (БА), у 33,6% (n=73) — атопический дерматит (АД). В равном проценте случаев (7,5%, n=14) выявлен аллергический ринит (АР), а также крапивница и ангионевротический отек в анамнезе. Непереносимость лекарственных средств в анамнезе отмечена у 17,1% (n=32) детей, отягощенный атопический семейный анамнез — в половине случаев (51,3% -96 детей).
Дети с рецидивирующим БОС, включенные в наше исследование, были госпитализированы в стационар преимущественно на поздние сроки от начала ОРИ (3-7 сутки). В ходе клинико-лабораторного обследования эозинофилия была выявлена у 18,7% (n=35), а уровень общего IgE превышал возрастную норму в 6,70±1,1 раза у 30% (n=56) детей.
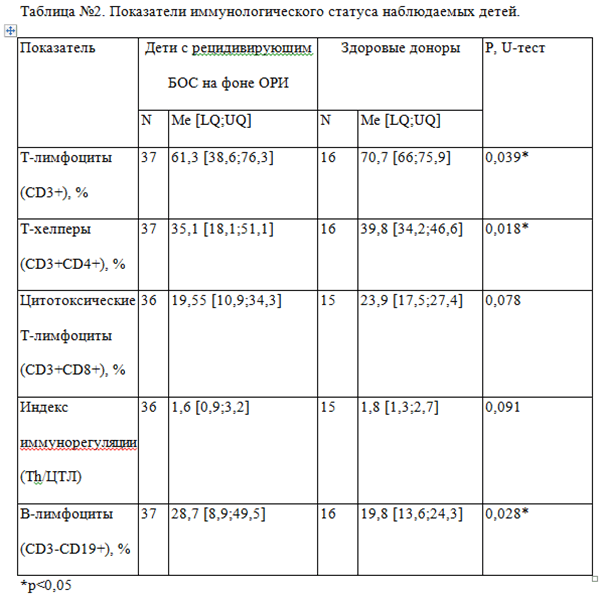
Иммунологическое обследование проведено у 37 детей из основной и 16 детей контрольной группы (здоровые доноры). При изучении субпопуляций лимфоцитов у пациентов с рецидивирующим БОС нами были выявлено достоверное снижение Т-лимфоцитов, в том числе Т-хелперов, и увеличение уровней В-лимфоцитов по сравнению с группой здоровых детей (таблица №2).
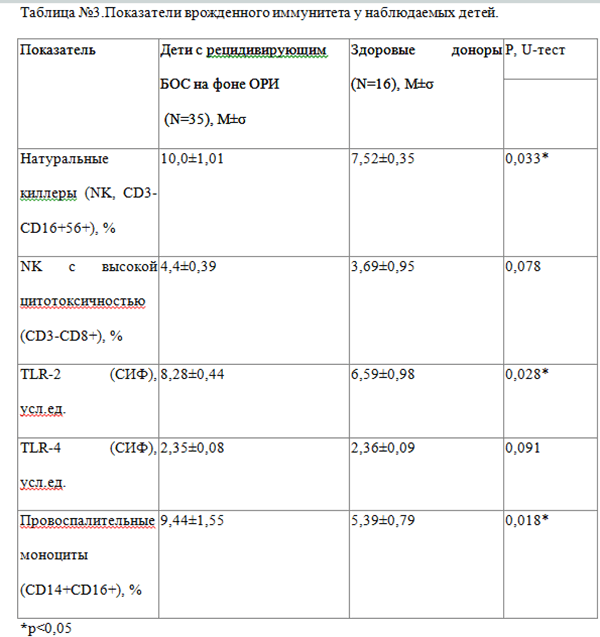
Изучение факторов врожденного иммунитета в группе детей с рецидивирующим БОС по сравнению с условно здоровыми донорами показало достоверное повышение уровня натуральных киллерных клеток (p=0,033) и провоспалительных моноцитов (p=0,018). Полученные данные свидетельствуют об активации иммунного ответа и возникновении воспалительной реакции у детей с ОРИ. Уровень экспрессии рецепторов TLR-2 также был выше в основной группе (p=0,028) и составил 8,28±0,44 усл.ед. против 6,59±0,98 усл.ед. в группе здоровых детей (таблица №3).
Анализируя полученные данные, было выявлено, что у детей, чаще переносивших в анамнезе бактериальные и бактериально-вирусные инфекции отмечено более высокое содержание в крови натуральных киллеров (r=0,49, p
В катамнезе (1 год) происходило достоверное снижение частоты ОРИ у детей, получавших Виферон® (с 6,3±1,5 случаев в год до 1,3±1,2 ОРИ). Кроме того, в группе А отмечено уменьшение частоты и длительности бронхообструктивного синдрома на фоне острой респираторной инфекции. Через год после терапии у всех детей уменьшилось количество или же полностью отсутствовали эпизоды бронхиальной обструкции. Длительность эпизодов бронхиальной обструкции до лечения составила в среднем 7,5±1,5 дней, спустя год после проведенной терапии она сократилась до 3,4±0,9 дней. А у детей с установленным диагнозом бронхиальная астма выявлено снижение частоты обострений (pЗаключение
У детей с БОС, рецидивирующим на фоне ОРИ, выявлены изменения со стороны врожденного иммунитета: нарастание натуральных киллеров, провоспалительных моноцитов, эозинофилов, что сопровождалось усилением экспрессией TLR2, находящейся в обратной зависимости от частоты ОРИ. Состояние адаптивного иммунитета характеризовалось дефицитными показателями клеточных эффекторов (Т-хелперов и В-лимфоцитов). Включение рекомбинантного интерферона альфа-2b с антиоксидантами в комплексную терапию детей с рецидивирующим БОС оказывает положительный терапевтический и протективный эффект, повышает резистентность к респираторным инфекциям и снижает частоту и длительность бронхиальной обструкции.
Литература
1. Инфекции респираторного тракта у детей раннего возраста. под ред. Г.А. Самсыгиной. М., Миклош, 2006, с. 10-12.
2. Бектимиров, Т.А. Вакцинопрофилактика гриппа. Лечащий врач, 2005, №9, с. 44-46
3. Таточенко В.К. Лечение обструктивных бронхитов и бронхиолитов детей раннего возраста. Методические рекомендации. М., 1990, с. 3-7
4. Артамонов Р.Г. О некоторых дискуссионных аспектах бронхообструктивных состояний у детей. Педиатрия, 1992(4-6), С. 71-73.
5. Самсыгина Г.А., Зайцева О.В., Корнюшин М.А. Бронхиты у детей. Отхаркивающая и муколитическая терапия. Приложение к журналу Педиатрия, М., 2000, с. 39
6. Каганов С.Ю. Бронхиальная астма у детей и ее классификация. В кн.: Бронхиальная астма у детей. Под ред. С.Ю. Каганова. М., 1999, с.12-26.
7. Гавалов С.М. Гиперреактивность бронхов как один из ведущих патофизиологических механизмов возникновения «рецидивов» бронхолегочных заболеваний у детей, перенесших пневмонию или ОРВИ. Детский доктор, 1999, № 4:19-23.
8. Почивалов А.В. Клинико — иммунологические аспекты рецидивирующих бронхитов и бронхиальной астмы у детей (проблемы оптимизации диагностики, лечения и реабилитации). Автореф. дисс докт. мед. наук, Воронеж, 1998, с. 2-4
9. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика».- 4-е изд., перераб. и доп. — М.: Оригинал-макет, 2012., с. 19-23
10. Педанова Е.А., Троякова М.А., Чернышова Н.И. Особенности рецидивирующего обструктивного бронхита у детей раннего возраста/ В кн. Пульмонология, Прил. 2003. Тринадцатый нац.конгр. по бол. орг. дых., Ст-Пет, 2003, с.188.
11. Рачинский С.В.., Таточенко В.К. Болезни органов дыхания у детей: Руководство для врачей. М. 1987, 495 с.
12. Середа Е.В. Бронхиты у детей: современные принципы терапевтической тактики. Фарматека, 2002, №11, с. 38-43.
13. Волков И.К. Дифференциальная диагностика бронхообструктивного синдрома у детей. Лечащий Врач, 2003, №8, с. 4-7.
14. Макарова С.А. Клинико-функциональные особенности бронхообструктивного синдрома у детей раннего возраста и способы его коррекции. Автореф. дис. … канд. мед. наук. М., 2004, 21 с.
15. Medzhitov R., Preston-Hurlburt P., Janeway C.A.J. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature 1997;24:388:6640:394—397.
16. Iwasaki A., Medzhitov R. Toll-like receptor control of the adaptive immune responses. Nat. Immunol., 2004, Vol. 5, N 10, P. 987—995.
17. Uematsu, S.; Akira, S. Toll-like receptors and type I interferons. J. Biol. Chem. 2007, 282, 15319-15324
18. Обоснование, опыт лечения и профилактика острых респираторных вирусных инфекций препаратами рекомбинантного интерферона: метод. рекомендации/ Правительство Москвы, Департамент Здравоохранения; М.: Спецкнига, 2012, с. 3-15
19. Нестерова И.В. Проблемы лечения вирусных инфекций у часто и длительно болеющих детей и взрослых: лекции для практикующих врачей. М., 2008, т.1, c..227-244
20. Кладова О. В., Замахина Е.В., Учайкин В.Ф. Иммунокоррегирующая терапия ОРЗ. Практика педиатра, 2006, №6, с. 8-12
21. Зайцева О.В. Бронхиальная астма у детей (факторы риска, принципы первичной и вторичной профилактики): Автореф. дис. … докт. мед. наук., М., 2001. — 48 с.
22. Зайцева О. В., Зайцева С. В. Бронхиальная астма и респираторные инфекции у детей. Вестник педиатрической фармакологии и нутрициологии, 2008, т. 5, № 1, с. 54–60.