М. П. Костинов1, 5 (vaccinums@gmail.com), И. В. Лукачёв1, А. К. Мещерякова1,О. О. Магаршак1, В. Б. Полищук1, Е. Б. Файзулоев1, Т. С. Гусева2, О. В. Паршина2,С. В. Новикова3, М. А. Игнатьева3, А. А. Сависько4,Н. И. Брико5
1 ФГБНУ «НИИ вакцин и сывороток им. И. И. Мечникова», Москва
2 ФГБУ «ФНИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России, Москва
3 ГБУЗ МО «Московский областной НИИ акушерства и гинекологии», Минздрава Московской обл., Москва
4 ГБОУ ВПО «Ростовский государственный медицинский Университет» Минздрава России, г. Ростов-на-Дону
5 ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России, Москва
Резюме
В работе представлен углубленный анализ данных литературных источников и собственного исследования о роли местно действующей формы рекомбинантного человеческого интерферона ?-2b (гель ВИФЕРОН) в лечении острых респираторных инфекций (ОРИ) на начальной стадии ОРИ у беременных с 14 недель гестации. Показано, что включение препарата ВИФЕРОН (интерферон ?-2b) в комплекс базисной терапии ОРИ у беременных приводит к уменьшению содержания в назальном смыве ИЛ-8, нарастания Т-лимфоцитов и Т-хелперов, более выраженной тенденции к снижению натуральных киллеров; положительно влияет на микробиоценоз слизистых оболочек верхних дыхательных путей; приводит к сокращению проявлений симптомов острого фарингита, бактериальных осложнений со стороны верхних дыхательных путей и, как следствие, сводит к минимуму потребность в системной антибактериальной терапии.
Сделан вывод о целесообразности включения в комплекс базисной терапии ОРИ у беременных препарата рекомбинантного интерферона ?-2b в форме интраназального геля.
Ключевые слова: острые респираторные инфекции, беременные, рекомбинантныый интерферон ?-2b
Preventing Complications in Pregnant Women with Mild and Moderate Severity of Acute Respiratory Infections
ООО ФеронM. P. Kostinov1, 5 (vaccinums@gmail.com), I. V. Lukachev1, A. K. Meshcheryakova1, O. O. Magarshak1, V. B. Polischuk1, E. B. Faizuloev1, T. S. Guseva2, O. V. Parshina2, S. V. Novikova3, M. A. Ignatieva3, A. A. Savisko4, N. I. Brico5
1 I. I. Mechnikov Research Institute of Vaccines and Sera of Russian Academy of Sciences, Moscow
2 Federal State Budget Institution «N. F. Gamaleya Federal Centre of Epidemiology and Microbiology» of the Ministry of Healthcare of the Russian Federation, Moscow
3 State Budgetary Institution of Public Health of Moscow region «Moscow Regional Research Institute of Obstetrics and Gynecology» of the Ministry of Healthcare of the Moscow region, Moscow
4 State Budgetary Educational Institution of Higher Professional Training «Rostov State Medical University» of the Ministry of Healthcare of the Russian Federation, Rostov-on-Don
5 Federal State Autonomous Educational Institution of Higher Education I. M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation.
Abstract
Relevance.
Pregnant women are often exposed to respiratory viruses. Occasionally, the fetus may be harmed by the virus.
Goal to present materials revealing the safety and effectiveness of local interferon therapy used in the initial stage of acute respiratory infection in pregnant women from 14 weeks of gestation.
Materials and methods. An in-depth analysis of the results of a study of the safety and efficacy of local interferon-therapy of respiratory infections presented in more than 60 literature sources, and own research.
Results. It is shown that the inclusion of interferon ?-2b (VIFERON) preparation in the complex of basic ARI therapy in pregnant women leads to a decrease in the content in the nasal washout of IL-8, the growth of T-lymphocytes and T-helpers, a more pronounced tendency to decrease natural killers; positively affects the microbiocenosis of the mucous membranes of the upper respiratory tract; leads to a reduction in symptoms of acute pharyngitis, bacterial complications from the upper respiratory tract and, as a consequence, minimizes the need for systemic antibacterial therapy.
Conclusions. The conclusion is made about the expediency of including the recombinant interferon ?-2b (VIFERON) preparation in intranasal gel form in the complex of basic ARI therapy in pregnant women.
Key words: acute respiratory infections, pregnant, recombinant interferon ?-2b
Введение
Группа острых респираторных инфекций (ОРИ) характеризуется полиэтиологичностью и широким диапазоном поражения разных отделов респираторного тракта. ОРИ определяют до 80% всей инфекционной патологии. Следует также отметить, что у беременных респираторные вирусные инфекции занимают одно из первых мест среди инфекционных заболеваний по частоте возникновения и не последнее место по числу осложнений и летальных исходов.
В настоящее время большинство специалистов-перинатологов рассматривают внутриутробное инфицирование вирусами респираторной группы в качестве одной из основных причин, вызывающих осложненное течение беременности (субкомпенсированные и декомпенсированные формы хронической фетоплацентарной недостаточности, гестозы средней тяжести и тяжелые) и неблагоприятные последствия для плода (синдром задержки развития плода, гипоксические поражения центральной нервной системы, инфекции перинатального периода, морфофункциональная незрелость, нарушение механизма передачи трансплацентарных антител и др.) [1–3].
Незначительное количество лекарственных препаратов, обладающих эффективностью в отношении разнообразия респираторных вирусов и разрешенных к использованию у женщин в период гестации, делают актуальным разработку и внедрение новых схем лечения и профилактики острых респираторных инфекций у беременных.
На сегодняшний день одним из перспективных направлений лечения и профилактики ОРИ являются местнодействующие формы рекомбинантного человеческого интерферона ?2b.
Цель данной работы – представить материалы, раскрывающие безопасность и эффективность местной интерферонотерапии, используемой на начальной стадии заболевания ОРИ у беременных с 14 недель гестации.
2. Материалы и методы
Проведен углубленный анализ представленных в более чем 60 литературных источниках результатов изучения безопасности и эффективности местной интерферонотерапии респираторных инфекций.
В собственном исследовании участвовали 74 беременные на 14-й неделе гестации, находившиеся под амбулаторным наблюдением. У 55 беременных регистрировались острые респираторные заболевания легкой и средней тяжести. В зависимости от проводимой терапии они были распределены на две группы:
I – 34 беременные, получавшие базисную терапию в сочетании с препаратом ВИФЕРОН;
II – 21 беременная с ОРИ, получавшие только базисную терапию.
Контрольная – 19 беременных с физиологическим течением беременности без признаков ОРИ. В базисную терапиию включали назальные деконгестанты, 0,9%-ный раствор хлорида натрия интраназально, мирамистин для обработки носа и/или глотки. При выявлении бактериальных осложнений ЛОР-органов назначали антибактериальные препараты местно (фузафунгин) или внутрь (амоксициллин) согласно общепринятым схемам, сроком до 7 дней.
Иммунокорригирующая терапия проводилась препаратом ВИФЕРОН в форме геля, он содержит человеческий рекомбинантный интерферон ?-2b в комбинации с альфа-токоферола ацетатом и разрешен к применению на любом сроке беремен ности (см. инструкцию по применению). Полоску геля длиной не более 0,5 см наносят на предварительно подсушенную поверхность слизистой оболочки носа и/или на поверхность небных миндалин 3–5 раз в день в течение 5 суток, при необходимости курс может быть продлен.
Методы, использованные для сбора/селекции доказательств
Поиск в электронных базах данных, материалы собственных исследований
Методы, используемые для оценки качества и силы доказательств
- Консенсус экспертов
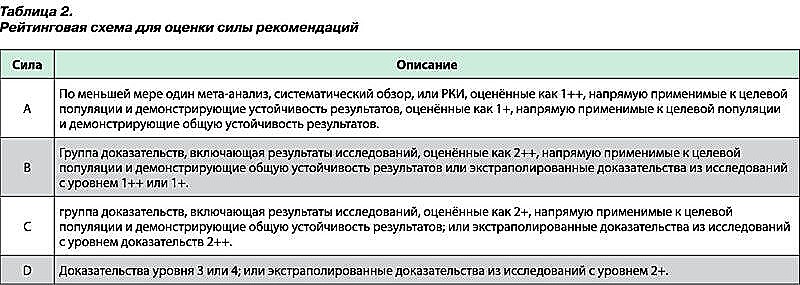
- Оценка значимости и соответствия с рейтинговой схемой (табл. 1)
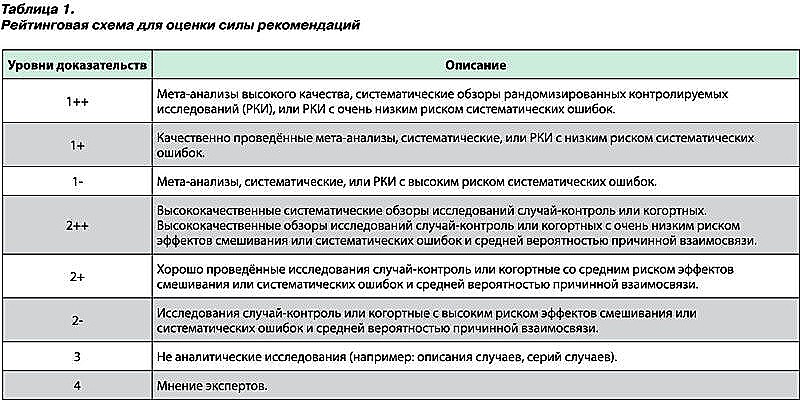
Методы, использованные для анализа доказательств
- Обзоры опубликованных мета-анализов
- Систематические обзоры с таблицами доказательств
Для исключения возможного влияния субъективного фактора результаты доступных научных публикаций и данные собственных исследований подвергались независимым экспертным оценкам как внутри страны, так и за рубежом.
При обработке статистических данных вычисляли среднюю квадратическую ошибку, медиану и нижний – верхний квартили при р ? 0,05.
Результаты и обсуждение
1. Частота выявления респираторных вирусов при острых респираторных инфекциях у беременных
Исследование было предпринято с целью предотвращения осложнений острых респираторных инфекций у женщин на основании изучения особенностей микробиоценоза слизистой оболочки глотки, мукозального иммунитета и возможности их коррекции при включении в комплексную терапию топической формы препарата интерферона человеческого рекомбинантного ?-2b (гель ВИФЕРОН).
Только в 27,5% рассмотренных литературных источников респираторные вирусы упоминаются в качестве этиологических факторов ОРИ, при этом на долю коронавирусов приходится 14,5%, риновирусов – 7%, вируса гриппа А – 3%, вируса гриппа В – 2,5%, РС-вируса – 0,5% [4, 5].
В нашей работе выделены со слизистой оболочки свода глотки в первые дни заболевания у 15 беременных (27,8% от общего числа наблюдаемых пациенток) и идентифицированы основные респираторные вирусы: парагриппа 2 и 3 – у двух женщин (1,8% и 1,8% соответственно), гриппа А – у двух женщин (1,8%), респираторно-синцитиальный – у четырех (7,3%), риновирус – у трех (5,5%), коронавирус – у пяти (9,1%) беременных. Таким образом, в структуре возбудителей ОРИ, выделенных у беременных с верифицированной вирусной инфекцией, превалировали коронавирус (33,3%), респираторно-синцитиальный вирус (26,6%), риновирус (20%). На долю вируса гриппа А, парагриппа 2 и 3 приходилось по 6,7%. По данным А.А. Зайцева с соавт., наиболее часто у взрослых встречаются риновирусы – 30 – 50%, на долю коронавирусов приходится 10 – 15%, вирусов гриппа – 5 – 15%, энтеровирусов, респираторно-синцитиальных вирусов, вирусов парагриппа и аденовирусов – по 5% [4]. Таким образом, полученные нами данные о доле отдельных возбудителей ОРВИ у беременных отличались от представленных А. А. Зайцевым с соавт. [4].
2. Частота выделения основных бактериальных возбудителей заболеваний верхних дыхательных путей у беременных
Современные представления о бактериальном поражении верхних дыхательных путей (ВДП) основаны на оценке различных механизмов защиты макроорганизма, препятствующих проникновению возбудителя в слизистую оболочку, а также степени колонизационной, инвазивной и токсической активности микроорганизмов, участвующих в развитии локального, а затем и диффузного воспалительного процесса [7]. При этом учитываются особенности защитных механизмов у детей, пожилых людей, женщин в периоде гестации, пациентов с вирусных инфекций [8].
По данным отечественных и зарубежных авторов, известно, что этиологически значимыми микроорганизмами при гнойно-воспалительных заболеваниях верхних дыхательных путей являются S. pneumoniae, H. influenzae, Moraxella catarrhalis, S. aureus, S. pyogenes, S. agalactiae и некоторые другие [9–11]. При этом многочисленные исследования посвящены видовой и количественной характеристике микрофлоры ВДП у детей и взрослых, как у здоровых, так и при различных заболеваниях [12–16]. У женщин в периоде гестации наиболее часто описывают дисбиоз урогенитального и, иногда, желудочно-кишечного тракта [17]. У беременных констатировано более тяжелое течение острых респираторных заболеваний [18, 19]. Однако бактерионосительство в периоде гестации не менее опасно, поскольку доказаны не только вертикальный или контактный пути передачи инфекции в неонатальном периоде, но и воздушно-капельный, приводящий к колонизации исходно стерильных верхних отделов респираторного тракта новорожденных [20].
При изучении микрофлоры слизистой оболочки глотки у женщин в период гестации с признаками ОРИ и без них выявлено доминирование грамположительных кокков, среди которых преобладали стрептококки (S. agalactiae, S. рyogenes, S. mutans), стафилококки вида S. аureus. Похожие данные описаны в работах В. Т. Пальчуна с соавт. при изучении микрофлоры слизистых оболочек ЛОР-органов в период гнойного воспаления у взрослых, а также А. С. Панькова при изучении бактериальных осложнений гриппа у взрослых [14, 15]. Однако в данных работах не указано превалирование S. agalactiae, тогда как частота выделения других микроорганизмов была схожей. Об опасности, представляемой S. agalactiae ( ?-гемолитический стрептококк группы В) для беременных, может свидетельствовать его способность вызывать как тяжелые воспалительные процессы у беременных и рожениц, так и бактериальные инфекции у новорожденных [21]. В настоящее время в развитых странах инвазивные формы инфекции, вызванной S. agalactiae, встречаются с частотой 0,35–1,13 на 1000 живых новорожденных и проявляются в виде сепсиса, пневмонии, иногда – менингита. Частота ранней формы инфекции (дебют в первые 7 суток с момента рождения) в настоящее время в среднем составляет 4–6%, причем среди доношенных новорожденных 2–3%, а среди недоношенных – 20–30% [22–24].
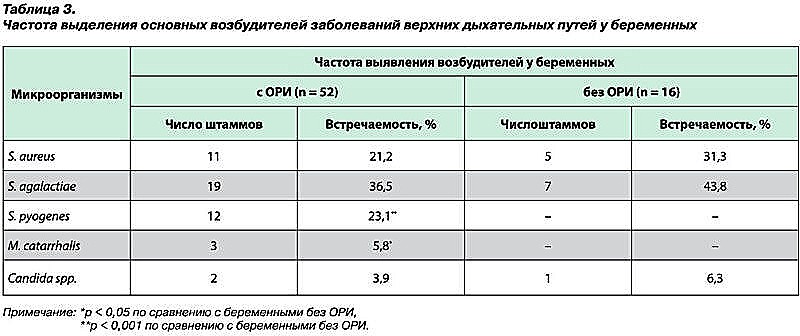
В проведенном исследовании установлено, что более тяжелое течение ОРИ отмечено у женщин, в слизистой оболочке глотки которых присутствовали условно-патогенные микроорганизмы – 21 пациентка (40,4%). У беременных без признаков ОРИ S. рyogenes и M. catarrhalis не высевались.
Выявлено, что у беременных с диагнозом ОРИ обсемененность слизистой глотки достигала 107– 108 КОЕ/мл, при этом в основном выделялись S. agalactiae и иногда – S. aureus и S. pyogenes. При этом у условно здоровых беременных не получено сливного роста ни одного этиологически значимого вида возбудителей, число патогенов не превышало 105–106 КОЕ/мл, и только у одного вида (S. agalactiae) отмечен массивный рост изолированных колоний (табл. 3).
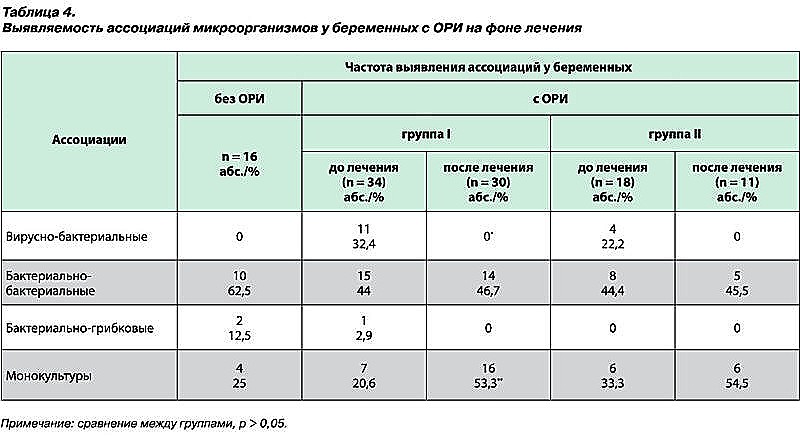
В большинстве случаев микроорганизмы формировали бактериальные (58,8%), иногда бактериально-грибковые (4,4%) ассоциации, тогда как монокультуры встречались в 36,8% случаев. Похожие результаты получены Е. Н. Андриановой при изучении микрофлоры слизистой глотки и полости носа у часто болеющих детей. У 40% детей микрофлора была представлена в виде монокультуры бактерий и у 60% пациентов выделялись сложные бактериальные ассоциации [10] (табл. 4).
3.3. Исследование микробиоценоза слизистой оболочки глотки у женщин в периоде гестации в процессе лечения назальной формой интерферона ?-2b
Следующим этапом нашей работы было исследование микробиоценоза слизистой оболочки глотки у женщин в периоде гестации в процессе лечения. Так, на фоне интерферонотерапии отмечена элиминация M. catarrhalis и Cаndida spp. В динамике среди пациенток группы I, получавших препарат интерферона ?-2b (гель ВИФЕРОН), выявлено уменьшение доли женщин с обсемененностью слизистой оболочки глотки микроорганизмами 105–106 КОЕ/мл с 29 до 10% (р > 0,05). Кроме того, исходно зарегистрированная в 24% случаев обсемененность микроорганизмами в 107–108 КОЕ/мл у пациенток группы I при повторном обследовании не определялась (р 0,05) констатирована элиминация бактериально-грибковой и вирусно-бактериально-грибковой ассоциаций в группе женщин, получавших препарат интерферона ?-2b (гель ВИФЕРОН) (табл. 5).
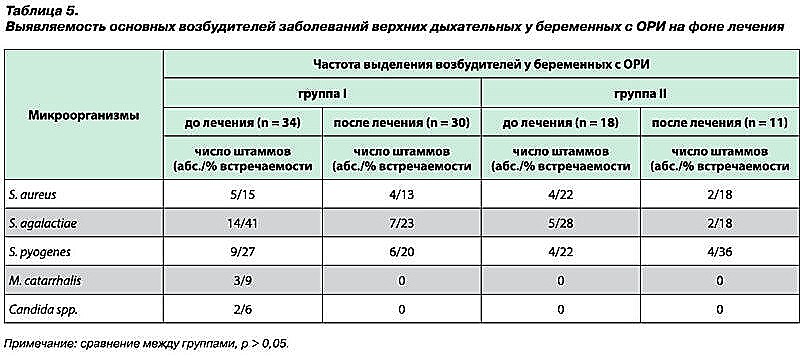
Таким образом, включение рекомбинантного интерферона ?-2b (гель ВИФЕРОН) в терапию ОРИ у беременных способствовало уменьшению степени обсемененности, снижению доли многокомпонентных ассоциаций и преобладанию монокультур в микробиоценозе слизистой оболочки задней стенки глотки [25, 26].
4. Мукозальный иммунитет при острых респираторных инфекциях у женщин в период гестации от 14 недель
Известно, что защита верхних дыхательных путей осуществляется взаимодействием механизмов врожденного, приобретенного иммунитета и неспецифических протективных факторов слизистых оболочек [27–29]. Секреты подслизистых желез содержат ?-1-антитрипсин, лизоцим, лизосомальные ферменты, трансферрин, интерферон, интерлейкины, антибактериальные пептиды, комплемент и иммуноглобулины [27, 29, 30]. Приобретенный иммунитет слизистых оболочек опосредуется антителами, относящимися главным образом к sIgA [28, 31]. Однако показатели местного иммунитета слизистой оболочки носа мало изучены у женщин как с физиологическим течением беременности, так и при ОРИ.
Кроме того, мы посчитали целесообразным изучить содержание в смывах со слизистой оболочки носа провоспалительного интерлейкина – ИЛ-8, который относится к семейству хемокинов, активирующих нейтрофилы и моноциты, вызывающих их хемотаксис в очаг воспаления, и повышенный уровень которого ассоциируется с активным воспалительным процессом [31].
В профилактике и лечении ОРИ, как у взрослых, так и у детей, большое внимание уделяют препаратам интерферона ?-2b, эффективность которых неоднократно показана в клинических исследованиях [32–35]. С целью снижения активности инфекционного процесса и профилактики акушерских и перинатальных осложнений беременным с урогенитальной инфекцией назначают препарат ВИФЕРОН в виде суппозиториев [35].
ВИФЕРОН – противовирусный и иммуномодулирующий препарат, в состав которого входит рекомбинантный интерферон альфа 2b в сочетании с антиоксидантным комплексом – токоферола ацетатом (витамин Е) и аскорбиновой кислотой. Препарат выпускается в различных лекарственных формах для системного (в виде ректальных суппозиториев) и местного (мазь, гель) применения. Поскольку проводили лечение топической формой препарата интерферона ?-2b, закономерным было исследование значений ИФН-? в назальном смыве.
В литературе не удалось найти нормальных значений секреторных ИФН-?, ИЛ-8, sIgA у женщин с физиологическим течением беременности, и одним из первых шагов в исследовании было изучение вышеуказанных показателей у беременных без признаков ОРИ. Поэтому значения ИФН-?, ИЛ-8, sIgA в смывах из полости носа полученные у беременных без признаков острой респираторной инфекции, которые составили 22 (5; 46,4) пг/мл, 1406 (968; 2225) пг/мл, 20,2 (11,6; 21,1) мг/л соответственно мы приняли за условную норму. Результаты исследования продемонстрировали более высокий уровень ИЛ-8 в назальном смыве у женщин с физиологическим течением беременности в сравнении со здоровыми взрослыми 1406 (968; 2225) пг/мл и 1009 (733; 1216) пг/мл соответственно, р
В единичных публикациях дана оценка некоторых показателей местного иммунитета в назальных смывах больных ОРИ [19, 36, 37]. Показано, что у детей первые дни заболевания сопровождаются снижением уровней ИФН-? (4,46 ± 0,6 пг/мл) и sIgA (8,84 ± 6,6 мг/л) с одновременным повышением содержания ИЛ-8 (528,0 ± 158,4 пг/мл) [37].
Нами в динамике выявлено снижение уровня ИЛ-8 от 1302,4 ± 160 пг/мл до 722,6 ± 119 пг/мл (р
Таким образом, включение препарата рекомбинантного интерферона ?-2 в комплекс терапии ОРИ у беременных приводит к уменьшению содержания в назальном смыве основного провоспалительного цитокина – ИЛ-8, что клинически соответствует снижению частоты бактериальных осложнений [38].
Полученные данные совпадают с результатами, полученными при интраназальном применении препарата рекомбинантного интерферона ?-2b (гель ВИФЕРОН) в комплексной терапии ОРИ у детей [39]. В другой работе показано, что у детей, получавших данный препарат в процессе лечения ОРИ, концентрация ИЛ-8 в назальных смывах изменялась незначительно (с 506,13 ± 165,7 пг/мл до 458,13 ± 161,8 пг/мл (p > 0,05), тогда как на фоне плацебо она достоверно увеличивалась (с 549,9 ± 150,3 пг/мл до 651,48 ± 170,3 пг/мл (p 0,05) [37].
5. Характеристика интерферонового статуса при острых респираторных инфекциях у беременных
Доказано, что в противовирусной защите организма участвуют неспецифические (цитокины (ФНО, ИЛ-2, 6, ИФН-?, -?, -? и др.), натуральные киллеры) и специфические (цитотоксические лимфоциты CD8+, Т-хелперы СD4+, Т-киллеры и В-лимфоциты, продуцирующие антитела) факторы [41]. При этом известно, что физиологическое течение беременности сопровождается иммуносупрессией, направленной на смещение цитокинового баланса в сторону продукции Тh2-иммуносупрессорных медиаторов (ИЛ-4, ИЛ-5, ИЛ-10) и снижение синтеза Тh1-цитокинов (ИЛ-2, ИФН-? и ФНО-альфа), что приводит к повышению риска вирусных и внутриклеточных инфекций [42–45].
Нами были изучены интерфероновый статус и субпопуляция лимфоцитов у беременных при ОРИ и как на них влияет препарат интерферона ?-2b (гель ВИФЕРОН).
Нами не выявлено различий в содержании ИФН-? и -? в сыворотке у беременных при наличии признаков респираторной инфекции. Так, при нормальном физиологическом течении беременности уровень сывороточного ИФН-? составил 6,3 ± 4,8 пг/мл, у женщин с признаками ОРИ – 10,2 ± 3,3 пг/мл; спонтанного ИФН-? – 1,3 ± 0,7 пг/мл и 3 ± 1,9 пкг/мл; индуцированного ИФН-? – 233,1 ± 44,7 пг/мл и 298,6 ± 49 пг/мл соответственно. У беременных без признаков ОРИ значения сывороточного ИФН-? составили 3,8 ± 1,5 пг/мл, у наблюдаемых с острым респираторным заболеванием – 1,9 ± 0,8 пг/мл, спонтанного ИФН-? – 2,9 ± 1,1 пг/мл и 3,25 ± 1,4 пг/мл, индуцированного ИФН-? 1077 ± 252 пг/мл и 711,1 ± 120 пг/мл соответственно. В литературе представлены данные об изменении приведенных выше показателей у взрослых пациентов с признаками ОРИ при первичном обращении по сравнению со здоровыми взрослыми. Установлено повышение сывороточного ИФН-? и спонтанного ИФН-? у больных с ОРИ – 83,5 ± 4,0 пг/мл и 77,0 ± 3,6 пг/мл соответственно, на фоне пониженного индуцированного ИФН-? 125,9 ± 4,3 пг/мл (у здоровых – 0,6±1,7 пг/мл; 32,2 ± 2,2 пг/мл и 239,2 ± 5,4 пкг/мл соответственно). Похожие изменения выявлены у пациентов с ОРИ относительно ИФН-?: сывороточного– 67,2 ± 3,2 пг/мл, спонтанного – 67,0 ± 4,0 пкг/мл, индуцированного – 110,0 ± 4,7 пг/мл (у здоровых – 34,1 ± 5,8 пг/мл; 36,6 ± 3,2 пг/мл и 357,4 ± 13,2 пг/мл соответственно) [47]. Полученные нами результаты совпадают с данными многочисленных исследований о снижении противовирусной защиты у беременных.
В проведенном исследовании не выявлено различий в содержании ИФН-? и ИФН-? в сыворотке у беременных в зависимости от получаемой терапии, что может служить индикатором безопасности проводимой терапии с использованием препарата интерферона ?-2b (гель ВИФЕРОН).
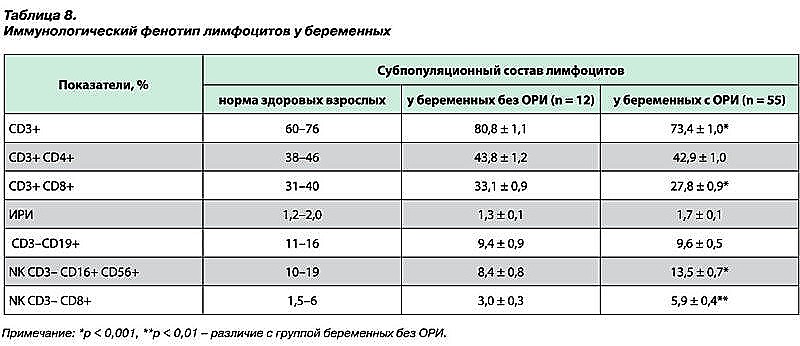
6. Особенности содержания субпопуляций лимфоцитов у женщин с острыми респираторными инфекциями в период гестации от 14 недель
Ранее было отмечено, что содержание Т-лимфоцитов (CD3+), Т-хелперов (CD3+ CD4+) и В-лимфоцитов (CD3- CD19+) у женщин с физиологическим течением беременности не отличается от такового у здоровых взрослых, составляя 60–76%, 38–46% и 11–16% соответственно. Снижается количество цитотоксических Т-лимфоцитов (CD3+ CD8+) при норме 31–40% и натуральных киллеров (CD3- CD16+ CD56+) при норме 10–19%, иммунорегуляторный индекс (CD4+/CD8+) повышается до 2,5 (норма – 1,2–2,0) [36, 48]. В нашем исследовании у женщин при физиологическом течении беременности были выявлены следующие особенности субпопуляционного состава лимфоцитов: более высокое содержание Т-лимфоцитов – 80,84 ± 1,07% и сниженное – натуральных киллеров – 8,43 ± 0,83%. При сравнении значений отдельных субпопуляций лимфоцитов у беременных с симптомами ОРИ и без них обнаружено снижение содержания CD3+ и CD3+ CD8+ у беременных с признаками ОРИ по сравнению с женщинами с физиологическим течением беременности (73,36 ± 0,99% и 80,84 ± 1,07%; 27,76 ± 0,94% и 33,07 ± 0,87% соответственно). Cодержание натуральных киллеров CD3– CD16+ CD56+ и CD3– CD8+ повышается у беременных с признаками ОРИ (13,5 ± 0,66% и 5,85 ± 0,38% соответственно (при физиологическом течении беременности – 8,43 ± 0,83% и 2,98 ± 0,33% соответственно), что может способствовать повышению риска самопроизвольного прерывания беременности (табл. 8).
.
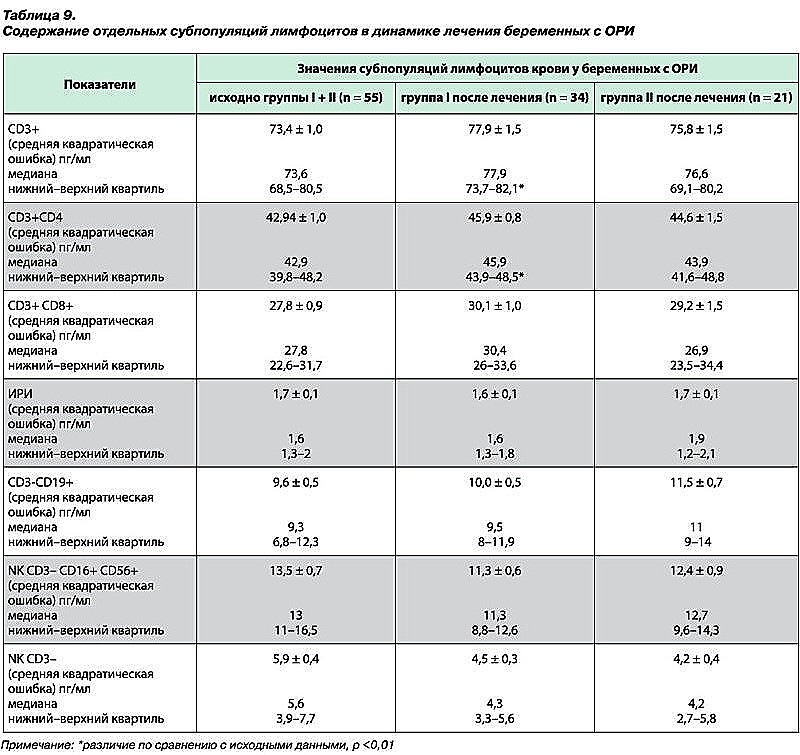
В период гестации у женщин с ОРИ, исходно имеющих более низкое содержание Т-лимфоцитов – 73,36 ± 0,99% и Т-хелперов – 42,94 ± 1,04, отмечено их нарастание на фоне интерферонотерапии (77,85 ± 1,5 и 45,9 ± 0,8 соответственно), подобная реакция при только базисной терапии отсутствует (75,83 ± 1,47 и 44,57 ±1,49 соответственно). В группе женщин, получавших в комплексе терапии препарат интерферона (гель ВИФЕРОН), в динамике более выражена тенденция к снижению NK-клеток, что наблюдается при физиологическом течении беременности. Содержание В-лимфоцитов как у беременных с признаками ОРИ, так и без них во все периоды исследования сопоставимо и ниже значений нормы (табл. 9).
В литературе описана депрессия клеточного механизма иммунного ответа у беременных с острым риносинуситом при отсутствии активации гуморального звена, что клинически может проявляться затяжным течением заболевания, увеличением риска развития рецидивов инфекции и осложнений гестации. Так, изменялись значения основных субпопуляций лимфоцитов в крови беременных с острым риносинуситом: CD3+ – 42,8 ± 10,7%, CD3+ CD4+ – 25,9 ± 6,8%, CD3+ CD8+ – 20,0 ± 6,3%, CD3– CD19+ – 11,3 ± 5,9%, CD3– CD16+ CD56+ – 9,2 ± 4,1% [49].
Следовательно, полученные данные свидетельствуют о том, что у беременных с острыми респираторными инфекциями легкого и среднетяжелого течения выявлен дисбаланс субпопуляций лимфоцитов, характеризующийся повышением содержания CD3–CD16+ CD56+ и CD3+CD8+, а также снижением содержания CD3+ и CD3+CD8+. Включение в комплекс базисной терапии беременных топической формы рекомбинантного интерферона ?-2b (гель ВИФЕРОН) в первые дни развития заболевания оказывает системное влияние на клеточное звено иммунитета, и приводит к восстановлению субпопуляционного состава лимфоцитов крови, характерного для физиологического течения беременности, и уменьшает риск развития воспалительных явлений [50].
7. Особенности течения острой респираторной инфекции у беременных в процессе интраназального применения интерферона ?-2?
В группе беременных с ОРИ, принимавших участие в исследовании, частота проявлений синдрома интоксикации и катаральных симптомов при первичном обращении была сопоставима. Исследование показало, что у беременных с ОРИ на фоне интерферонотерапии и без нее с одинаковой частотой встречаются такие местные симптомы заболевания, как чувство першения и боль в глотке, слизисто-гнойное отделяемое из носа, кашель со скудной слизистой или гнойной мокротой. Тем не менее следует отметить, что у пациенток группы I (базисная терапия + гель ВИФЕРОН) проявления симптомов острого фарингита уменьшили с 29,4 до 5,9% (р
Различия между группами выявлены также в отношении частоты бактериальных осложнений ВДП (острый гнойный синусит, острый гнойный трахеобронхит). Частота бактериальных осложнений в группе I составила 11,8%, тогда как в группе II (только базисная терапия) – 38,1% (р
Выводы
- Препарат интерферона ?-2b (гель ВИФЕРОН) проявляет при ОРИ у беременных иммунокорригирующее действие в виде: уменьшения содержания в назальном смыве ИЛ-8, нарастания Т-лимфоцитов и Т-хелперов, более выраженной тенденции к снижению натуральных киллеров.
- Включение препарата ВИФЕРОН в форме геля (интерферона ?-2b) в комплекс базисной терапии ОРИ у беременных положительно влияет на микробиоценоз слизистых оболочек верхних дыхательных путей, приводя: к элиминации M. catarrhalis и Cаndida spp., бактериально-грибковой и вирусно-бактериально-грибковой ассоциаций: к сокращению доли женщин с обсемененностью слизистой оболочки глотки микроорганизмами с 29 до 10% (р > 0,05) и к исчезновению исходно зарегистрированной в 24% случаев обсемененности микроорганизмами, к увеличению доли монокультур. ВИФЕРОН – противовирусный и иммуномодулирующий препарат, в состав которого входит рекомбинантный интерферон альфа 2b в сочетании с антиоксидантным комплексом – токоферола ацетатом (витамин Е) и аскорбиновой кислотой. Препарат выпускается в различных лекарственных формах для системного применения (в виде ректальных суппозиториев) и местного (мазь, гель).
- Назначение препарата рекомбинантного интерферона ?-2b (гель ВИФЕРОН) сопровождается сокращением частоты проявлений симптомов острого фарингита, бактериальных осложнений со стороны верхних дыхательных путей и, как следствие, сводит к минимуму потребность в системной антибактериальной терапии.
Целесообразность включения в комплекс базисной терапии ОРИ у беременных препарата ВИФЕРОН в форме геля подтверждается научными исследованиями и многолетней клинической практикой.
Литература
- Бочарова И. И., Костинов М. П., Новикова С. В., Шмитько А. Д., Обидина А. А., Цивцивадзе Е. Б. Трансплацентарные антитела к вирусу кори у новорожденных при различном течении беременности у их матерей // Российский вестник акушера-гинеколога. 2014; 2 (14): 14–18.
- Шмитько А. Д., Новикова С. В., Бочарова И. И., Якубина А. А., Костинов М. П. Механизмы и факторы, влияющие на трансплацентарную передачу IgG-антител в системе мать-плацента-плод // Российский вестник акушера-гинеколога. 2014; 6 (14): 27–31.
- Костинов М. П., Черданцев А. П., Семенова С. С., Тарбаева Д. А., Сависько А. А., Серова О. Ф. и др. Акушерские и перинатальные исходы после вакцинации против гриппа или перенесенной респираторной инфекции // Гинекология. 2015; 3 (14): 43–46.
- Зайцев А. А., Горелов А. В., Клочков О. И. Острые респираторные вирусные инфекции: перспективы противовирусной терапии // Вестник семейной медицины. 2009; 5: 18–23.
- Синопальников А. И. Простуда. Внебольничные инфекции дыхательных путей. М.: Премьер МТ-Наш Город, 2007: 131–144
- Wiselka M. J., Nicholson K. G., Kent J., Cookson J. B., Tyrrell D. A. Prophylactic intranasal alpha 2 interferon and viral exacerbations of chronic respiratory disease. Thorax. 1991; 46: 706–711.
- Хан М. А., Микитченко Н. А., Червинская А. В. Динамика показателей мукозального иммунитета, цитобактериологического и морфофункционального состояния слизистой ротоглотки у часто болеющих школьников под влиянием галотерапии // Аллергология и иммунол. в педиатрии. Ч. I. 2011; 1 (24): 33 –36; Ч. II. 2011; 2 (25): 30–34.
- Новиков Д. К., Выхристенко Л. Р., Новиков П. Д. Иммунология и аллергология для ЛОР-врачей: Руководство для врачей / ред. Д. К. Новиков. М.: Медицинское информационное агентство, 2006: 512.
- Пальчун В. Т., Кафарская Л. И., Кунельская Н. Л., Артемьев М. Е., Гуров А. В. Микробный пейзаж и пути рациональной антибиотикотерапии при острых гнойных заболеваниях ЛОР-органов // Лечебное дело. 2004; 4: 88–95.
- Bartlett J. G. IDCP guidelies: management of upper respiratory tract infections. Infect. Dis. Clin. Practice. 1997; 6: 212–220.
- Miravitlles M., Espinosa C., Fernandes-Laso E., Martos J. A., Maldonado J. A., Gallego M. Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD. Study Group of Bacterial Infection in COPD. Chest 1999; 116: 40–46.
- Андрианова Е. Н., Снегирева Н. Ю., Рывкин А. И. Дисбиоз верхнего отдела респираторного тракта и изменения функционального состояния органов дыхания у часто болеющих детей // Педиатрия. 2009; 2: 35–39.
- Извин А. И., Катаева Л. В. Микробный пейзаж слизистой оболочки верхних дыхательных путей в норме и патологии // Вестник оториноларингологии. 2009; 2: 65–68.
- Пальчун В. Т., Кафарская Л. И., Полякова Т. С., Гуров А. В. Динамическое исследование антибиотикорезистентности микробного фона в оториноларингологическом отделении // Вестник оториноларингологии. 2004; 1: 53–56.
- Паньков А. С. Бактериальные осложнения гриппа и их прогнозирование // Известия Самарского научного центра Российской академии наук. 2012; т. 14; 5 (2): 490–493.
- Ермолина Г. Б., Беляева Е. В., Дегтева Г. К., Меньков Н. В., Борискина Е. В. Особенности микрофлоры дыхательных путей при различных респираторных заболеваниях // Нижегородский медицинский журнал. 2004; 1: 17–21.
- Зациорская С. Л., Башмакова М. А., Калашникова Е. П. Генерализованная инфекция плода и новорожденного, вызванная стрептококками группы В // Вопросы охраны материнства и детства, 1987: 60–62.
- Лопатин А. С. Диагностика и лечение ринита и риносинусита у беременных // Российский аллергологический журнал 2006; 1. Доступно на: http://www.allergy-journal.ru/journals/2006/1.
- Григорьева А. А. Роль интерферона в возникновении и лечении острого гнойного синусита. Автореф. дис. … канд. мед. наук. М., 2004: 143.
- Дэвис П. А., Готефорс Л. А. Бактериальные инфекции плода и новорожденного / пер. с англ. А. Г. Румянцева. М.: Медицина, 1987: 496.
- Кудин А. П., Маржало Е. Ю. Клинические особенности и этиотропное лечение менингита, вызванного Streptococcus agalactiae, у детей // Медицинский журнал. 2012; 3: 135–138.
- Berner R. Infektionen durch Gruppe-B-Streptokokken in der Neonatalperiode. Monatsschr. Kinderheild. 2003; 151: 373–383.
- Heath P. T., Balfour G. F., Tighe H., Verlander N. Q., Lamagni T. L., Efstratiou A. Group B streptococcal disease in infants: a case control study. Arch. Dis. Child. 2009; 39: 674–680.
- Prevention of perinatal group B streptococcal disease: Revised guidelines from CDC, 2010. MMWR. 2010; 59 (RR 10): 1–32.
- Костинов М. П., Мещерякова А. К., Фошина Е. П., Тарбаева Д. А., Сависько А. А., Зайцева Е. В. Клиническое течение острой респираторной инфекции и состояние микробиоценоза верхних дыхательных путей у беременных // ЖМЭИ. 2012; 5: 12–16.
- Мещерякова А. К., Костинов М. П., Магаршак О. О., Зайцева Е. В. Видовая и количественная характеристика микрофлоры слизистой оболочки глотки у беременных // ЖМЭИ. 2014; 2: 93–97.
- Кильсенбаева Ф. А. Состояние местного иммунитета слизистых оболочек верхних дыхательных путей в норме и при воспалении. Автореф. дис. … канд. мед. наук. Уфа, 2002: 24.
- Цывкина А. А., Лусс Л. В., Царев С. В. Мукозальный иммунитет при патологии верхних дыхательных путей // Российский аллергологический журнал. 2011; 2: 22–26.
- Mestecky J., Russell M. W., Elson Ch. O. Perspectives on Mucosal Vaccines: Is Mucosal Tolerance a Barrier? // The Journal of Immunology. 2011: 5634–5637.
- Mellert T. K., Gatchell M. L., Sparks L., Getchellet T. V. Characterization of the immune barrier in human olfactory mucosa // Otolaryng. Head. Neck. Surg. 1992; 106 (2): 181–188.
- Быкова В. П. Слизистая оболочка носа и околоносовых пазух как иммунный барьер верхних дыхательных путей // Российская ринология. 1993; 1: 40–46.
- Деньгин В. В., Деленян Н. В. Виферон: применение при инфекционно-воспалительных заболеваниях // Фарматека. 2005; 12: 53–57.
- Колобухина Л. В. Виферон в лечении и профилактике острых респираторных вирусных инфекций // РМЖ. 2003; 11 (5): 306.
- Кривопустов С. П. Интерназальное применение рекомбинантного интерферона альфа в педиатрии // Здоровье Украины 2010; 1: 32.
- Захарова И. Н., Торшхоева Л. Б., Заплатников А. Л., Коровина Н. А, Малиновская В. В., Чеботарева Т.А. и др. Особенности системы интерферона при острых респираторных инфекциях и клинико-иммунологическая эффективность модифицированной интерферонотерапии у детей раннего возраста // Эффективная фармакотерапия. Педиатрия. 2011; 1: 70–73.
- Акимкин В. Г., Коротченко С. И., Шевцов В. А., Волгин А. Р., Салмина Т. А., Калабухова Л. Ю. и др. Эпидемиологическая и иммунологическая эффективность использования препарата Виферон, гель для профилактики гриппа и других острых респираторных инфекций в организованных воинских коллективах // Эпидемиология и инфекционные болезни. Актуальные вопросы. Доступно на: http://www.epidemiology-journal.ru/ru/archive/article/11365 jn 20.01.2014.
- Курбанова Х. И. Клинико-иммунологическое обоснование местной интерферонотерапии при респираторных вирусных инфекциях у детей. Автореф. дисс. … канд. мед. наук. М., 2012: 36.
- Мещерякова А. К., Костинов М. П., Магаршак О. О., Гусева Т. С., Паршина О. В., Парфенов В. В. и др. Показатели местного иммунитета у беременных с острой респираторной инфекцией на фоне интерферонотерапии // Вопросы гинекологии, акушерства и перинатологии. 2014; т. 13; 2: 44–46.
- Малиновская В. В., Мазанкова Л. Н., Коровина Н. А. Курбанова Х. И., Глухарева Н. С., Короид Н. В. Современные возможности использования интерферонов в комплексной терапии острых респираторных инфекций у детей // Лечащий врач. 2011: 8.
- Чернушевич И. И. Клинико-иммунологическое обоснование применения рекомбинантного интерлейкина-1? (Беталейкина) в лечении больных хроническим гнойным средним отитом. Автореф. дис. … канд. мед. наук. СПб., 2000: 24.
- Хашукоева А. З., Ибрагимова М. И., Хашукоева З. З., Бурденко М. В. Возможности применения Виферона (ФЕРОН) в акушерско-гинекологической практике // Эффективная фармакотерапия. Акушерство и гинекология. 2007; 4: 23–27.
- Алешкин В. А., Ложкина А. Н., Загородняя Э. Д. Иммунология репродукции: пособие для врачей, ординаторов и научных работников. Чита, 2004: 79.
- Хонина Н. А. Проявления и механизмы формирования иммуносупрессии на различных этапах репродуктивного процесса в норме и при патологии. Автореф. дис. … д-ра мед. наук. 2007: 195.
- Matthiesen L., Khademi M., Ekerfelt C., Berg G. In situ detection of both inflammatory and anti-inflammatory cytokines in resting peripheral blood mononuclear cells during pregnancy. J. Reprod. Immunol. 2003; 58: 49–59.
- Sakai M., Tsuda H., Tanebe К. Sasaki Ya., Saito Sh. Interleukin-12 secretion by peripheral blood mononuclear cells is decreased in normal pregnant subjects and increased in preeclamptic patients. Am. J. Reprod. Immunol. 2002; 47: 91–92.
- Сухих Г. Т., Ванько Л. В. Иммунология беременности. М., 2003: 400.
- Костинов М. П., Хромова Е. А.,Сависько А. А., Костинова А. М. Функциональные особенности иммунной системы при физиологическом течении беременности и их взаимосвязь с вакцинацией против гриппа // Consilium Medicum. 2016; Том 18; 6: 59–62.
- Образцова Е. В., Осидак Л. В., Головачева Е. Г. Интерфероновый статус у детей при острых респираторных инфекциях // Интерферонотерапия. Бюллетень эксперементальной биологии и медицины 2009; 8: 22 –26.
- Леонтьева Г. М. Особенности иммунопатологических проявлений острого риносинусита в гестационном периоде. Дис. … канд. мед. наук. 2009: 102.
- Костинов М. П., Лукачев И. В., Мещерякова А. К., Дмитриева Е. В., Ахматова Н. К., Хромова Е. А. и др. Индукция эффекторов врожденного и адаптивного иммунитета в процессе лечения топической формой рекомбинантного интерферона- ?2b при респираторных инфекциях у беременных // ЖМЭИ. 2017; 2: 38–45.
- Мещерякова А. К., Костинов М. П., Кытько О. В., Малиновская В. В., Тарбаева, Д. А., Никонова А. А. и др. Клинический эффект применения различных лекарственных форм Виферона у беременных с острой респираторной инфекцией // Эффективная фармакотерапия. Акушерство и гинекология. 2010; 4: 46–49.
- Мещерякова А. К., Костинов М. П., Магаршак О. О., Гусева Т. С., Паршина О. В. Влияние препарата рекомбинантного интерферона ?-2b в форме геля на течение ОРИ и состояние мукозального иммунитета у женщин в периоде гестации от 14 недель // Вестник оториноларингологии. 2014; 6: 50–53.
- Афиногенова В. П., Лукачев И. В., Костинов М. П. Иммунотерапия: механизм действия и клиническое применение иммунокорригирующих препаратов // Лечащий врач. 2010; 4: 9.
- Федеральное руководство по использованию лекарственных средств (формулярная система, справочное издание). Вып. XVII / ред. А. Г. Чучалин, В.В. Яснецов. М.: Видокс, 2016: 745–768.
- Аллергология и иммунология. Национальное руководство / ред. Р. М. Хаитов, Н. И. Ильина. М.: ГЭОТАР-Медиа, 2014: 656.
- Клинико-иммунологическая эффективность иммунобиологических препаратов: справочник / ред.М. П. Костинов, Н. А. Озерецковский/ М.: Миклош, 2004: 256.
- Аверьянов А. В., Бабкин А. П., Барт Б. Я., Волчецкий А. Л., Минина Е. С., Козырев О. А. и др. Эргоферон и осельтамивир в лечении гриппа – результаты многоцентрового сравнительного рандомизированного клинического исследования // Антибиотики и химиотерапия. 2012. 7–8 (57): 23–30.
- Гуревич К. Г. Разработка систем интраназальной доставки лекарственных средств. Качественная клиническая практика. 2002; 1.
- Hayden F. G., Albrecht J. K., Kaiser D. L. Prevention of natural colds by contact prophylaxis with intranasal alpha 2-interferon. N. Engl. J. Med. 1986; 314 (2): 71–75.
- Jefferson T. O., Tyrrell D. Antivirals for the common cold. The Cochrane Database of Systematic Reviews. 2005; Issue 3.
- Алпенидзе Д. Н., Борзанова М. В., Маклакова Е. В., Романова М. В., Черняева Е. В. Современные подходы к терапии ОРВИ у взрослых: результаты клинического исследования назального спрея интерферона ?. В кн.: Справочник поликлинического врача. 2010; 9.
References
- Bocharova I. I., Kostinov M. P., Novikova S. V., Shmit’ko A. D, Obidina A. A., Tsivtsivadze E. B. Transplacental antibodies to measles virus in newborns in different pregnancy in their mothers // Rossiyskiy vestnik akushera-ginekologa. [Russian Bulletin of Obstetrician-Gynecologist]. 2014; 2 (14): 14–18.
- Shmit’ko A. D., Novikova S. V., Bocharova I. I., Yakubina A. A., Kostinov M. P. et al. Mechanisms and factors affecting the transplacental transmission of IgG antibodies in the mother-placenta-fetus system // Rossiyskiy vestnik akushera-ginekologa. [Russian Bulletin of Obstetrician-Gynecologist]. 2014; 6 (14): 27–31.
- Kostinov M. P., Cherdantsev A. P., Semenova S. S., Tarbaeva D. A., Savis’ko A. A., Serova O. F. et al. Obstetric and perinatal outcomes after vaccination against influenza or respiratory infection // Ginegologiya. [Gynecology]. 2015; 3 (14): 43–46.
- Zaitsev A. A., Gorelov A. V., Klochkov O. I. Acute respiratory viral infections: perspectives of antiviral therapy // Vestnik semeinoi medicini. [Herald of Family Medicine]. 2009; 5: 18–23.
- Sinopalnikov A. I. The Common Cold. Community-acquired infections of the respiratory tract. Moscow. Premier MT-Our City; 2007: 131–144.
- Wiselka M. J., Nicholson K. G., Kent J., Cookson J. B., Tyrrell D. A. Prophylactic intranasal alpha 2 interferon and viral exacerbations of chronic respiratory disease. Thorax. 1991; 46: 706–711.
- Khan M. A., Mikitchenko N. A., Chervinskaya A. V. Dynamics of mucosal immunity indices, cytobacteriological and morphofunctional state of the mucous oropharyngeal mucosa in children with frequent pain under the influence of halotherapy // Allergology and immunol. in pediatrics. Part I. Allergologiya i immunologia v pediatrii. [Allergology and Immunology in Pediatrics]. Part II. 2011; 1 (24): 33 –36; Часть II. 2011; 2 (25): 30–34.
- Novikov D. K., Vykhristenko L. R., Novikov P. D. Immunology and allergology for ENT doctors: A guide for physicians. Ed.: D. K. Novikov. Moscow: Medical Information Agency. 2006: 512.
- Palchun V. T., Kafarskaya L. I., Kunelskaya N. L., Artemiev M. E., Gurov A. V. Microbial landscape and ways of rational antibiotic therapy in acute purulent diseases of the ENT organs // Lechebnoje delo [General Medicine]. 2004; 4: 88–95.
- Bartlett J. G. IDCP guidelies: management of upper respiratory tract infections. Infect. Dis. Clin. Practice. 1997; 6: 212–220.
- Miravitlles M., Espinosa C., Fernandes-Laso E., Martos J. A., Maldonado J. A., Gallego M. Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD. Study Group of Bacterial Infection in COPD. Chest 1999; 116: 40–46.
- Andrianova E. N., Snegireva N. Yu., Ryvkin A. I. Dysbiosis of the upper respiratory tract and changes in the functional state of respiratory organs in children are often sick. Pediatria // Zhurnal imeni Speranskogo. [Journal «Pediatria» named after G.N. Speransky]. 2009; 2: 35–39.
- Izvin A. I., Kataeva L. V. The microbial landscape of the mucous membrane of the upper respiratory tract in norm and pathology // Vestnik otorinolaringologii. [Bulletin of Otorhinolaryngology 2009; 2: 65–68.
- Pal’chun V. T., Kafarskaia L. I., Polyakova T. S., Gurov A. V. Dynamic investigation of the antibiotic resistance of the microbial background in the otorhinolaryngological department // Vestnik otorinolaringologii. [Bulletin of Otorhinolaryngology]. 2004; 1: 53–56.
- Pan’kov A. S. Bacterial complications of influenza and their prediction // Izvestiya samarskogo nauchnogo centra RAN. [News of the Samara Scientific Center of the Russian Academy of Sciences]. 2012; vol. 14; 5 (2): 490–493.
- Ermolina G. B., Belyaeva E. V., Degteva G. K., Menkov N. V., Boriskina E. V. Features of the microflora of the respiratory tract in various respiratory diseases // Nizhegorodsky medicinsky zhurnal. [Nizhny Novgorod Medical Journal]. 2004; 1: 17–21.
- Zatsiorskaya S. L., Bashmakova M. A., Kalashnikova E. P. Generalized infection of the fetus and newborn caused by Group B streptococci // Voprosy okhrany materinstva i detstva [Problems of Maternity and Child Care]. 1987: 60–62.
- Lopatin A. S. Diagnosis and treatment of rhinitis and rhinosinusitis in pregnant women // Rossiyskiy allergologicheskiy zhurnal. [Russian Allergology Journal]. 2006; 1. Available at: http://www.allergy-journal.ru/journals/2006/1.
- Grigorieva A. A. The role of interferon in the onset and treatment of acute purulent sinusitis. Doctorate of med. sci. diss. Moscow. 2004: 143.
- Davis P. A., Gotefors L. A. Bacterial infections of fetus and newborn / A. G. Rumyantsev transl. from english. Moscow. Medicine; 1987: 496.
- Kudin AP, Marzal E. Yu. Clinical features and etiotropic treatment of meningitis caused by Streptococcus agalactiae in children // Medical Journal. 2012; 3: 135–138.
- Berner R. Infektionen durch Gruppe-B-Streptokokken in der Neonatalperiode. Monatsschr. Kinderheild. 2003; 151: 373–383.
- Heath P. T., Balfour G. F., Tighe H., Verlander N. Q., Lamagni T. L., Efstratiou A. Group B streptococcal disease in infants: a case control study. Arch. Dis. Child. 2009; 39: 674–680.
- Prevention of perinatal group B streptococcal disease: Revised guidelines from CDC, 2010. MMWR. 2010; 59 (RR 10): 1–32.
- Kostinov M. P., Meshcheryakova A. K., Foshina E. P., Tarbaeva D. A., Savisko A. A., Zaitseva E. V. Clinical course of acute respiratory infection and microbiocenosis of the upper respiratory tract in pregnant women // Zhurnal mikrobiologii, epidemiilogii i immunologii. [Journal of Microbiology Epidemiology and Immunobiology]. 2012; 5: 12–16.
- Meshcheryakova A. K., Kostinov M. P., Magarshak O. O., Zaytseva E. V. Species and quantitative characteristics of the microflora of the mucous membrane of the pharynx in pregnant women // Zhurnal mikrobiologii, epidemiilogii i immunologii. [Journal of Microbiology Epidemiology and Immunobiology]. 2014; 2: 93–97.
- Kilsenbaeva F. A. State of local immunity of the mucous membranes of the upper respiratory tract in norm and with inflammation. Doctorate of med. sci. diss. Ufa. 2002: 24.
- Tsyvkina A. A., Luss L. V., Tsarev S. V. Mucosal immunity in the pathology of the upper respiratory tract // Rossiyskiy allergologicheskiy zhurnal. [Russian Allergology Journal]. 2011; 2: 22–26.
- Mestecky J., Russell M. W., Elson Ch. O. Perspectives on Mucosal Vaccines: Is Mucosal Tolerance a Barrier? The Journal of Immunology. 2011: 5634–5637.
- Mellert T. K., Gatchell M. L., Sparks L., Getchellet T. V. Characterization of the immune barrier in human olfactory mucosa. Otolaryng. Head. Neck. Surg. 1992; 106 (2): 181–188.
- Bykova V. P. Mucous membrane of the nose and paranasal sinuses as the immune barrier of the upper respiratory tract // Rossiyskaya Rinologiya. [Russian Rhinology]. 1993; 1: 40–46.
- Den’gin V. V., Delenyan N. V. Viferon: use in infectious and inflammatory diseases // Farmateka. [Pharmateca]. 2005; 12: 53–57.
- Kolobukhina LV Viferon in the treatment and prevention of acute respiratory viral infections // Zhurnal mikrobiologii, epidemiilogii i immunologii. [Journal of Microbiology Epidemiology and Immunobiology]. 2003; 11 (5): 306.
- Krivopustov S. P. Intranasal application of recombinant interferon alfa in pediatrics // Zdorovje Ukraini. [Health of Ukraine]. 2010; 1: 32.
- Zakharova I. N., Torshkhoyeva L. B., Zaplatnikov A. L., Korovina N. A., Malinovskaya V. V., Chebotareva T. A. et al. Features of the interferon system in acute respiratory infections and clinical-immunological efficacy modified interferon therapy in young children // Effective pharmacotherapy. Pediatria. Zhurnal imeni Speranskogo. [Journal «Pediatria» named after G.N. Speransky]. 2011; 1: 70–73.
- Akimkin V. G., Korotchenko S. I., Shevtsov V. A., Volgin A. R., Salmina T. A., Kalabukhova L. Yu. et al. Epidemiological and immunological efficacy of the drug viferon, gel for the prevention of influenza and other acute respiratory infections in organized military collectives // Epidemiologiya i infektsionnye bolezni. Aktualnye voprosy. [Epidimiology and Infectious Diseases. Current Issues]. Available at: http://www.epidemiology-journal.ru/ru/archive/article/11365 jn 20.01.2014.
- Kurbanova Kh. I. Clinical and immunological grounds for local interferon therapy for respiratory viral infections in children. Doctorate of med. sci. diss. Moscow; 2012: 36.
- Meshcheryakova A. K., Kostinov M. P., Magarshak O. O., Guseva T. S., Parshina O. V., Parfenov V. V. et al. Indices of local immunity in pregnant women with acute respiratory infection against interferon therapy // Voprosi ginekologii, akusherstva i perinatologii. [Gynecology, Obstetrics and Perinatology]. 2014; том 13; 2: 44–46.
- Malinovskaya V. V., Mazankova L. N., Korovina N. A., Kurbanova Kh. I., Glukhareva N. S., Koroid N. V. Current possibilities of using interferons in complex therapy of acute respiratory infections in children // Lechaschii Vrach. [Lechaschii Vrach Journal].2011: 8.
- Chernushevich I. I. Clinical and immunological basis for the use of recombinant interleukin-1 beta (Betaleukina) in the treatment of patients with chronic purulent otitis media. Doctorate of med. sci. diss. St. Petersburg; 2000: 24.
- Khushukoyeva A. Z., Ibragimova M. I., Khashukoyeva Z. Z., Burdenko M. V. Possibilities of using Viferon (PHERON) in obstetric-gynecological practice.Effektivnaya farmakoterapia // Akusherstvo i ginekologia. [Effective pharmacotherapy. Obstetrics and gynecology]. 2007; 4: 23–27.
- Aleshkin V. A., Lozhkina A. N., Zagorodnyaya E. D. Immunology of reproduction: a manual for physicians, attending physician and researchers. Chita. 2004: 79.
- Khonina N. A. Manifestations and mechanisms of the formation of immunosuppression at various stages of the reproductive process in norm and in pathology. PhD of med. sci. diss. 2007: 195.
- Matthiesen L., Khademi M., Ekerfelt C., Berg G. In situ detection of both inflammatory and anti-inflammatory cytokines in resting peripheral blood mononuclear cells during pregnancy // J. Reprod. Immunol. 2003; 58: 49–59.
- Sakai M., Tsuda H., Tanebe К. Sasaki Ya., Saito Sh. Interleukin-12 secretion by peripheral blood mononuclear cells is decreased in normal pregnant subjects and increased in preeclamptic patients // Am. J. Reprod. Immunol. 2002; 47: 91–92.
- Sukhikh G. T., Vanko L. V. Immunology of pregnancy. Moscow. 2003: 400.
- Kostinov M. P., Khromova E. A., Savis’ko A. A., Kostinova A. M. Functional features of the immune system in the physiological course of pregnancy and their relationship with vaccination against influenza // Consilium Medicum. 2016; Vol. 18; 6: 59–62.
- Obraztsova E. V., Osidak L. V., Golovacheva Ye. G. Interferon status in children with acute respiratory infections // Interferonotherapy. Bulleten’ experimental’noi biologii i medicini. [Bulletin of Experimental Biology and Medicine]. 2009; 8: 22–26.
- Leont’eva G. M. Features of immunopathological manifestations of acute rhinosinusitis in the gestational period. Doctorate of med. sci. diss. 2009: 102.
- Kostinov M. P., Lukachev I. V., Meshcheryakova A. K., Dmitrieva Ye. V., Akhmatova N. K., Khromova E. A. et al. Induction of the effectors of congenital and adaptive immunity in the treatment with the topical form of the recombinant interferon-?2b for respiratory infections in pregnant women // Zhurnal mikrobiologii, epidemiilogii i immunologii. [Journal of Microbiology Epidemiology and Immunobiology]. 2017; 2: 38–45.
- Meshcheryakova A. K., Kostinov M. P., Kytko O. V., Malinovskaya V. V., Tarbaeva D. A., Nikonova A. A. et al. Clinical effect of the use of various medicinal forms of Viferon in pregnant women with acute respiratory infection // Effektivnaya farmakoterapia. Akusherstvo i ginekologia. [Effective pharmacotherapy. Obstetrics and gynecology]. 2010; 4: 46–49.
- Meshcheryakova A. K., Kostinov M. P., Magarshak O. O., Guseva T. S., Parshina O. V. Influence of the preparation of recombinant interferon ?-2b in the form of gel on the ARI and the state of mucosal immunity in women in the 14 weeks gestation // Vestnik otorinolaringologii. [Bulletin of Otorhinolaryngology]. 2014; 6: 50–53.
- Afinogenova V. P., Lukachev I. V., Kostinov M. P. Immunotherapy: mechanism of action and clinical use of immunocorrecting drugs // Lechaschii Vrach. [Lechaschii Vrach Journal]. 2010; 4: 9.
- Federal guidance on the use of medicines (formular system, reference publication). Issue XVII / Ed.: A. G. Chuchalin, V. V. Yasnetsov. Moscow. Widox. 2016: 745–768.
- Allergology and Immunology. National leadership / Ed.: R. M Haitov, N. I. Il’ina. Moscow. GEOTAR-Media. 2014: 656.
- Clinical and immunological efficacy of immunobiological preparations. Reference book. Ed.: M. P. Kostinov, N. A. Ozeretskovsky. Moscow. Miklosh. 2004: 256.2004: 256.
- Averyanov A. V., Babkin A. P., Bart B. Ya., Volchetzky A. L., Minina E. S., Kozyrev O. A. et al. Ergoferon and oseltamivir in the treatment of influenza – the results of a multicenter, comparative, randomized clinical research // Antibiotiki i himioterahia. [Antibiotics and Chemotherapy]. 2012. 7–8 (57): 23–30.
- Gurevich K. G. Development of intranasal drug delivery systems. Kachestvennaia klinicheskaia praktika. [Good Clinical Practice]. 2002; 1.
- Hayden F. G., Albrecht J. K., Kaiser D. L. Prevention of natural colds by contact prophylaxis with intranasal alpha 2-interferon // N. Engl. J. Med. 1986; 314 (2): 71–75.
- Jefferson T. O., Tyrrell D. Antivirals for the common cold. The Cochrane Database of Systematic Reviews. 2005; Issue 3.
- Alpenidze D. N., Borzanova M. V., Maklakova E. V., Romanova M. V., Chernyaeva E. V. Modern approaches to adult acute respiratory viral therapy in adults: results of a clinical study of nasal spray interferon ?. Reference book to polyclinic doctor. 2010; 9.
Впервые опубликовано в журнале «Эпидемиология и Вакцинопрофилактика», 2018, т. 17, №1 (98), С. 62–73.




