А.А. Лындин, В.В. Длин, В.В. Малиновская, Е.А. Ружицкая, Т.С. Гусева, О.В. Паршина, М.Б. Бояджан, М.Ю. Юдин.
ФГУ МНИИ педиатрии и детской хирургии Минздравсоцразвития России, Москва.
ФГУ НИИЭМ им.Н.Ф.Гамалея Минздравсоцразвития России, Москва.
Детская городская клиническая больница №13 им. Н.Ф. Филатова, Москва.
Изложены результаты клинического исследования по изучению уровня альфа-интерферона у детей с первичным гормоночувствительным нефротическим синдромом в зависимости от активности нефротического синдрома, наличия активной/реактивированной герпесвирусной инфекции, вызванной вирусом простого герпеса, цитомегаловирусом и вирусом Эпштейн-Барр. Выявлены выраженные изменения уровня альфа-интерферона у детей с гормоночувствительным нефротическим синдромом: имеет место значительное снижение уровня индуцированной продукции альфа-интерферона, что указывает на значительное снижение противовирусной защиты. Представлены данные о положительном эффекте включении препарата рекомбинантного альфа2-интерферона в комплексную терапию гормоночувствительного нефротического синдрома у детей.
Введение
Интерферон (ИФН) был открыт в 1957г. как белок, обладающий противовирусной активностью. Интерфероны – цитокины полипептидной природы, обладающие антивирусной, иммуномодулирующей и противоопухолевой активностью, что позволяет отнести их к полифункциональным биорегуляторам широкого спектра действия и гомеостатическим агентам [1].
Интерфероны представляют собой обширную группу белков и подразделяются на 2 типа: ИФН ? типа и ИФН ?? типа. К ИФН ? типа относятся альфа-интерферон (?-ИФН), бета-интерферон (?-ИФН), а так же дельта-интерферон (?-ИФН), омега-интерферон (?-ИФН), тау-интерферон (?-ИФН). Они представляют собой полиморфное семейство белков с гомологией первичной структуры и близким спектром биологических активностей. К ИФН ?? типа относится гамма-интерферон (?-ИФН) [2, 3].
В настоящее время наиболее изученными являются 3 основных класса интерферонов: ?-ИФН (также называется лейкоцитарным ИФН, что подчеркивает только первичный источник выделения), ?-ИФН (фибробластный ИФН, по первичному источнику выделения), ?-ИФН (отнесен к иммунным ИФН, что соответствует его происхождению и основным функциям). Наиболее выраженным полиморфизмом отличается класс ?-ИФНа, в составе которого идентифицированы около 22 вариантов: ?1-ИФН, ?2-ИФН, ?3-ИФН и т.д. [1, 2].
Исследование параметров интерферонового статуса позволяет выявить недостаточность системы интерферона. В настоящее время для оценки интерферонового статуса возможно определение сывороточного, спонтанно продуцированного и индуцированного как ?-ИФН, так и ?-ИФН. Сывороточный уровень ИФНа отражает непосредственное его содержание в периферической крови, уровень продукции индуцированного интерферона отражает способность лейкоцитов к продукции интерферона в ответ на стимуляцию индукторами (для ?-ИФНа – вирусные индукторы, для ?-ИФНа – химические индукторы, такие как стафилококковый энтеротоксин А (СЭА), фитогемагглютинин (ФГА), конканавалин А (КонА)). Здоровые люди характеризуются низким уровнем сывороточного интерферона и высокими значениями индуцированного синтеза интерферонов. Спонтанная продукция интерферона может быть определена, как уровень продукции интерферона при инкубации лейкоцитов без какой-либо стимуляции; повышение этого уровня – показывает произошедшее эндогенное индуцирование интерферон-продуцирующих клеток, чаще всего за счет – наличия вирусной инфекции [1].
Острые вирусные инфекции и стрессовые ситуации, сопровождаются повышением уровня циркулирующего (сывороточного) интерферона и снижением уровня индуцируемой продукции альфа- и гамма-интерферонов лейкоцитами. Хронические вирусные инфекции сопровождаются подавлением всех показателей интерферонового статуса. Снижение продукции альфа- и гамма-интерферона, которое может быть и причиной, и следствием острых и хронических вирусных заболеваний, может рассматриваться как показание для интерферон-стимулирующей терапии [1].
Исследование по изучению роли интерферонов при гломерулонефрите (ГН) в детских популяциях редки. Так при исследовании небольшой группы детей югославские авторы описывают снижение уровня индуцированной продукции ?-ИФН клетками периферической крови при рецидивирующем гормоночувствительном нефротическом синдроме (ГЧНС) (в рецидиве и на фоне стероидной терапии), однако в ремиссии ГЧНС уровни индуцированного ?-ИФН не отличались от контрольных [4]. Об определенном снижении интерферонообразования у детей страдающих гломерулонефритом неоднократно отмечали и отечественные исследователи [5, 6]. Так Длин В.В. (1993) на основании проведенного исследования группы из 83 детей страдающих различными формами гломерулонефрита, описывает достоверное снижение интерферонообразования, причем достоверных различий в зависимости от клинических форм гломерулонефрита не было получено [5]. Изучение интерферонового статуса в 2 группах детей с гормонорезистентным нефротическим синдромом (ГРНС) и ГЧНС показало значительное снижение продукции ИФН-? и ИФН-? относительно нормативных показателей, при этом уровень сывороточного ИФН был повышен по сравнению с нормой. И хотя изменения были однотипны, в группе детей с ГРНС наблюдались достоверно более выраженные нарушения интерферонового статуса (ИФН-?, ИФН-?, сывороточный ИФН), по сравнению с детьми с ГЧНС [6].
Благоприятный эффект же от терапии с использованием ?-ИФН, наблюдаемой у людей с гломерулонефритом некоторые авторы связывают с противовирусным эффектом, а не модуляцией интраренальных патофизиологических механизмов [7].
В последние годы все большее внимание уделяется роли вирусной инфекции в развитии разнообразной патологии человека, в том числе и заболеваний органов мочевой системы [8, 9, 10, 11]. В этой связи особую актуальность приобретает проблема вирусассоциированных заболеваний почек, в особенности гломерулонефрита. Следует отметить, что для гломерулонефрита, ассоциированного с вирусной инфекцией, характерны: высокая частота обострений, смешанный мочевой синдром в виде протеинурии, гематурии и резистентность к иммуносупрессивной терапии [9, 12]. Можно ожидать, что, когда имеет место участие вирусной инфекции в патогенезе гломерулонефрита, при эффективном использовании противовирусной терапии может наблюдаться улучшение со стороны течения и клинических проявлений гломерулонефрита.
Гломерулонефрит ассоциированный с экстраренальными вирусными инфекциями, инициализируется обычно посредством сложных реакций компонентов иммунной системы. Так, например иммуноглобулины циркулирующих иммунных комплексов (ЦИК) могут повреждать гломерулярные клетки при активации Fc рецепторов, но способствуют ли комплексы вирусных нуклеиновых кислот гломерулярному воспалению, остается неизвестным. Молекулярные патологические механизмы, посредством которых вирусные инфекции могут вызывать гломерулонефрит, остаются неясными [13, 14].
Группа герпесвирусных инфекционных заболеваний одна из наиболее распространенных и плохо контролируемых инфекций человека. Для герпес-вирусных инфекций характерна высокая распространенность в человеческой популяции с первичным инфицированием в детском возрасте [15, 16, 17]. По литературным данным антитела к ним выявляются у 40-100% взрослого населения планеты (т.е. они являются IgG-сероположительными) [15, 18, 19, 20, 21].
Лечение герпесвирусной инфекции до настоящего времени остается сложной задачей. Все разнообразие методов лечения и профилактики герпесвирусных инфекций, в конечном счете, сводится к трем главным подходам: иммунотерапии (препараты внутривенных иммуноглобулинов, интерферонов и вакцинации), химиотерапии (с применением препаратов аномальных нуклеозидов), либо к комбинации этих способов. Иммунотерапия герпесвирусных заболеваний включает в себя также терапевтическое использование интерферонов [15, 22].
Современная противовирусная терапия эффективно уменьшает клинические проявления герпесвирусной инфекции, однако не предотвращает рецидивов заболевания [15]. В связи с этим предпринимаются попытки непосредственного воздействия на иммунную систему с целью стимуляции специфических и неспецифических ее факторов. В современной литературе трудно найти единое мнение по применению противовирусных препаратов в нефрологии, в частности при различных клинико-морфологических вариантах гломерулонефрита [5, 8, 15, 23]. Учитывая вышеуказанные данные, можно полагать, что комбинированное применение противовирусных препаратов снизит частоту и интенсивность герпесвирусных инфекций, что возможно приведет к положительной динамике основного заболевания (гломерулонефрита).
Цель исследования: изучить состояние системы ?- и ?-интерферонов и оценить эффективность включения рекомбинантного ?2-интерферона («Виферон®») в комплекс лечения первичного гормоночувствительного синдрома.
Материалы и методы
Было обследовано 38 детей, страдающих первичным нефротическим синдромом (НС), в том числе 7 детей с дебютом нефротического синдрома, 8 – с рецидивирующим течением гормоночувствительного варианта нефротической формы гломерулонефрита, 23 – с гормонозависимым вариантом нефротической формы гломерулонефрита. Фильтрационная функция почек у всех пациентов была сохранна. Состав по полу был с преимущественным преобладанием мальчиков – 29 (76%), против 9 (24%) девочек. Возраст детей был от 2 до 17 лет, средний возраст составил 9,9±0,7 лет. Степень активности НС определялась согласно критериям по М.С.Игнатовой (1989) с изменениями [24].
Все пациенты по степени активности НС были разделены на 3 группы: в ? группу вошло 12 детей с активностью НС ??-??? степени, в том числе 8 мальчиков (67%) и 4 девочки (33%), средний возраст 9,9±1,3 лет; во ?? группу включено 20 детей с низкой активностью гормоночувствительного НС (ГЧНС) (? степени), в том числе 16 мальчиков (80%) и 4 девочки (20%), средний возраст 10,2±0,9 лет; ??? группа – 6 детей, находящихся более 4-х месяцев в ремиссии НС, в том числе 5 мальчиков (83%) и 1 девочка (17%), средний возраст 9,0±1,6 лет. Контрольную группу составили 8 практически здоровых детей, в том числе 6 мальчиков (75%) и 2 девочки (25%), средний возраст составил 8,78±0,86 лет. Таким образом, изучаемые группы по полу и возрасту достоверно не отличались (р>0,05).
Всем детям основных групп и группы контроля проводилось определение уровней ?-ИФНа и ?-ИФНа в сыворотке крови (в том числе сывороточный уровень и уровни спонтанной и индуцированной продукции). Для определения интерферонового статуса использовалась венозная кровь, постановку тестов производили в день забора крови. Инкубацию, разведенной средой крови, производили при 37°С в атмосфере 5% СО2 в течении 24 часов. Для индукции ?-ИФНа использовался раствор, содержащий вирус болезни Ньюкасла. Концентрацию ?-ИФН в сыворотке крови определяли иммуноферментным методом с применением наборов альфа-Интерферон-ИФА-БЕСТ (ЗАО Вектор-Бест, г.Новосибирск-117). Оценка результатов проводилась с помощью ИФА-анализатора «Antos-2020» (Австрия).
23 детям, принявшим участие в исследовании, и всем детям группы контроля проводилось исследование крови (лейкоконцентрат) и мочи (осадок мочи) на наличие цитомегаловируса (ЦМВ), Эпштейн-Барр вируса (ЭБВ), вируса простого герпеса (ВПГ) методом полимеразной цепной реакции (ПЦР) с применением соответствующих наборов «Herpes simplex virus 1 type», «Human cytomegalovirus», «Epstein-Barr virus» (НПФ «Гентех», Москва). Определение наличия антител класса М и G проводили с помощью иммуноферментного метода (ИФА) с применением коммерческих иммуноферментных наборов тест-систем для выявлению соответствующих иммуноглобулинов НПО «Диагностические системы», Москва.
Статистическая обработка полученных данных проводилась при помощи программы «STATISTICA 6.0». Проверка нормальности распределения осуществлялась с помощью критерия Колмогорова-Смирнова. При отличном от нормального распределения признаков, использовались непараметрические статистические методы. Изучение различий двух несвязанных групп проводилось с использованием критерия Манна-Уитни. Для определения корреляции применялся непараметрический коэффициент корреляции Спирмена. При проверке статистических гипотез наличие статистической значимости определялось при значении рРезультаты и их обсуждение
У детей с первичным ГЧНС независимо от активности процесса средний уровень сывороточного ?-ИФНа был выше по сравнению с группой контроля, но только у детей в ремиссии НС была достоверная разница (р0,05). Средний уровень индуцированной продукции ?-ИФНа у детей с первичным ГЧНС вне зависимости от активности НС был достоверно ниже чем в группе контроля (р0,05).
Таблица 1.
Уровень ?-ИФН (М±m) у детей с первичным ГЧНС в зависимости от активности НС
|
№ |
Группы |
?-ИФН, пкг/мл |
||
|
Сывороточный |
Спонтанная продукция |
Индуцированная продукция |
||
| 1. | ? группа, n=12 |
3,79±1,80 |
2,22±0,99 |
543,05±166,69 |
| 2. | ?? группа, n=20 |
3,58±2,22 |
2,98±1,02 |
407,97±86,97 |
| 3. | ??? группа, n=6 |
29,03±9,80 |
9,42±7,44 |
425,45±147,48 |
| 4. | Группа контроля, n=8 |
0,87±0,87 |
3,61±2,12 |
1511,51±521,91 |
| Р 1-2 |
р>0,05; |
р>0,05; |
р>0,05; |
|
| Р 1-3 |
р>0,05; |
р>0,05; |
р>0,05; |
|
| Р 1-4 |
р>0,05; |
р>0,05; |
р |
|
| Р 2-3 |
р>0,05; |
р>0,05; |
р>0,05; |
|
| Р 2-4 |
р>0,05; |
р>0,05; |
р |
|
| Р 3-4 |
р |
р>0,05; |
р |
|
23 ребенка основной группы, которым проводилось вирусологическое обследование для выявления ЦМВ, ВПГ и ЭБ-вирусной инфекции методом ПЦР, были разделены на 4 группы: группу А составили 14 детей с отрицательными результатами определения ЦМВ, ВПГ, ЭБВ в крови и моче в том числе 11 мальчиков (79%), 3 девочки (21%), средний возраст 9,14±0,97 лет; группу Б – 9 детей с положительной реакцией хотя бы на один из определяемых герпес-вирусов в крови и/или моче, в том числе 5 мальчиков (56%) и 4 девочки (44%), средний возраст 6,72±0,95 лет; группа В – группа контроля составили 8 практически здоровых детей, в том числе 6 мальчиков (75%) и 2 девочки (25%), средний возраст 8,78±0,86 лет, все дети которой, имели отрицательные результаты определения ЦМВ, ВПГ, ЭБВ в крови и моче.
Таблица 2.
Уровень альфа-ИФН (М±m) у детей с первичным ГЧНС в зависимости от персистенции герпес-вирусов.
|
№ |
Группы |
?-ИФН, пкг/мл |
||
|
Сывороточный |
Спонтанная продукция |
Индуцированная продукция |
||
| А. | ПЦР (-)*, n=14 |
6,64±4,16 |
5,94±3,24 |
504,04±141,50 |
| Б. | ПЦР (+)**, n=9 |
6,75±4,60 |
0,84±0,50 |
447,24±235,21 |
| В. | Группа контроля, n=8 |
0,87±0,87 |
3,61±2,12 |
1511,51±521,91 |
|
|
|
|
||
| р (А-Б) |
р>0,05 |
р>0,05 |
р>0,05 |
|
| р (А-В) |
р>0,05 |
р>0,05 |
р |
|
| р (Б-В) |
р>0,05 |
р>0,05 |
р |
|
| * — дети с ГЧНС без активной/реактивированной ГВИ по данным ПЦР | ||||
| ** — дети с ГЧНС с выявленной активной/реактивированной ГВИ по данным ПЦР | ||||
Независимо от установления факта инфицирования герпес-вирусными инфекциями (ВПГ, ЦМВ, ЭБВ) средний уровень сывороточного ?-ИФНа был выше чем в контрольной группе (табл. 2). Средний уровень спонтанной продукции ?-ИФНа достоверно не зависел от наличия персистирующей герпес-вирусной инфекции (ГВИ) и не отличался от группы контроля. Средний уровень индуцированной продукции ?-ИФНа не зависел от наличия персистирующей герпес-вирусной инфекции, но был достоверно ниже, чем в группе контроля (табл. 2).
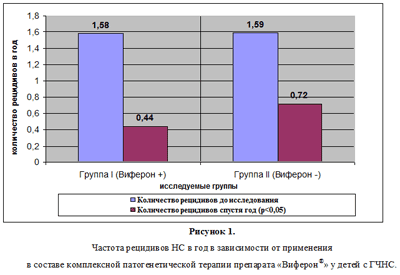
36 детей основной группы (2 ребенка из 38 выбыли из исследования по возрасту), были разделены на 2 группы: группу ? составили 18 детей которые в комплексной терапии НС получали препарат ?2-ИФНа («Виферон®») с противовирусной и иммуномодулирующей целями (1 суппозиторию 2 раза/сут с интервалом 12ч в течение 10 дней ежедневно, затем — 3 раза в неделю через день в течение 4-6 месяцев (до 7 лет 150 тыс.МЕ 2 раза в день, старше 7 лет – 500 тыс.МЕ 2 раза в день), в составе 4 случая дебюта НС, 4 – рецидивирующего варианта НС, 11 – ГЗНС; в том числе 13 мальчиков (72%), 5 девочки (28%), средний возраст 6,7±0,7 лет; группу ?? – 18 детей без включения препарата «Виферон®» в комплексную терапию НС, в составе 3 случаев дебюта НС, 4 – рецидивирующего варианта НС, 10 – ГЗНС, в том числе 13 мальчиков (72%) и 5 девочек (28%), средний возраст 9,3±1,1 лет; Дети обоих групп достоверно не отличались по проводимой патогенетической иммуносупрессивной терапии (с применением препаратов глюкокортикоидных гормонов, хлорбутина, циклоспорина –А, микофетил микофенолата в стандартных дозировках).
Средний уровень количества рецидивов НС до и после включения препарата «Виферон®» в группе ? составил 1,58±0,24 и 0,44±0,17 рецидива в год, соответственно. В группе без включения в терапию препарата «Виферон®» (группа ??) количество рецидивов НС до включения в исследование и спустя год наблюдения составило 1,59±0,26 и 0,72±0,21 рецидивов в год, соответственно (р®» приводит к снижению частоты рецидивов НС, однако учитывая небольшое число исследуемых, трудно оценить его влияние у детей с рецидивирующим ГЧНС и ГЗНС.
Заключение и обсуждение результатов
У детей контрольной группы отмечается низкий уровень сывороточного и высокий уровень индуцированной продукции ?-ИФНа, что указывает на отсутствие и/или активной (реактивированной) персистирующей вирусной инфекции.
У детей с ГЧНС независимо от активности НС отмечался низкий уровень индуцированной продукции ?-ИФНа по сравнению с контрольной группой, что соответствует данным литературы [4, 5]. Достоверных различий сывороточного уровня ?-ИФНа в зависимости от активности процесса не выявлено. У детей с длительной ремиссией ГЧНС имелась тенденция к его более высокому уровню. В отличие от этого различий в уровне спонтанной продукции ?-ИФНа не получено ни с группой контроля, ни в зависимости от активности процесса.
В отличие от этого, при первичном ГЧНС независимо от активности процесса наблюдался более высокий уровень сывороточного ?-ИФНа и значительное снижение уровня индуцированного ?-ИФНа, что характерно для активной (реактивированной) персистирующей вирусной инфекции. Следует отметить, что аналогичные изменения интерферонового статуса, в виде повышения сывороточного ИФН и значительного снижения индуцированной продукции ИФН-? и ИФН-? у детей с ГРНС и ГЧНС были описаны Лутошкиным И.В. (2005) [6]. Уровень спонтанной продукции ?-ИФНа не отличался в основных группах и группе контроля. Отсутствие различий сывороточного и спонтанно продуцированного уровней ?-ИФНа сыворотки крови между детьми с установленной активной/реактивированной ГВИ и без неё, можно объяснить возможным наличием других вирусных инфекций в группе детей без активной/реактивированной ГВИ страдающих ГЧНС.
Включение Виферона® в комплекс лечения пациентов с ГЧНС ассоциированным с ГВИ позволяет снизить частоту рецидивов, что косвенно указывает на значение вирусной инфекции в частоте рецидивов НС.
Таким образом, у детей с первичным ГЧНС имеет место значительное снижение уровня индуцированной продукции ?-ИФНа независимо от активности НС и персистенции ГВИ, что указывает на значительное снижение противовирусной защиты в этой группе пациентов. Включение длительной, до 3х месяцев виферонотерапии в комплекс терапии ГЧНС.
Литература:
1. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств) (Монография). М.: «ГЭОТАР-Медиа», 2005. 368 с.
2. Ковальчук Л.В., Ганковская Л.В., Рубакова Э.И. Система цитокинов (Учебное пособие). М.: «Янус-К», 2000. 64 с.
3. Ярилин А.А. Система цитокинов и принципы ее функционирования в норме и патологии // Иммунология. 1997. № 5. С.7-14.
4. Stefanovi? V., Golubovi? E., Miti?-Zlatkovi? M. et al. Interleukin-12 and interferon-gamma production in childhood idiopathic nephrotic syndrome // Pediatr Nephrol. 1998. Vol. 12. N 6. P. 463-466.
5. Длин В.В. Патогенетическое значение персистирующей вирусной инфекции при гломерулонефрите у детей и обосновании противовирусной и иммуномодулярной терапии.: дис. доктора. мед. наук. М. 1993. 430 с.
6. Лутошкин И.С. Клинико-патогенетическое значение и тактика лечения персистирующей герпесвирусной инфекции у детей с гормонорезистентным и гормоночувствительным вариантами нефротического синдрома. Автореф. … дис. канд. мед. наук. М. 2005. 26 с.
7. Segerer S., Hudkins K.L., Taneda S. et al. Oral interferon-alpha treatment of mice with cryoglobulinemic glomerulonephritis // Am J Kidney Dis. 2002. Vol. 39. N 4. P. 876-888.
8. Горчакова Л.Н. Роль герпес-вирусной инфекции в прогрессировании остропротекающего гломерулонефрита и обоснование использования альфа2–рекомбинантного интерферона.: Автореф. дис… канд. мед. наук. М. 1999. 24 с.
9. Длин В.В., Чумакова О.В. Роль вирусной инфекции в этиологии и патогенезе гломерулонефрита у детей. // Материалы II Российского Конгресса «Современные методы диагностики и лечения в детской нефрологии и урологии». М. 2002. С. 12-19.
10. Прокопенко Е.И. Вирусные инфекции и трансплантация почки. // Нефрология и диализ. 2003. T. 5. № 2. С. 108 – 116.
11. Becker J.L., Miller F., Nuovo G.J., et al. Epstein-Barr virus infection of renal proximal tubule cells: possible role in chronic interstitial nephritis. // J. Clin. Invest. 1999. Vol. 104. N. 12. P. 1673 – 1681.
12. Беляева В.В. Эпидемиология и инфекционные болезни. М.: «Медицина», 1996. С. 54 – 56.
13. H?gele H. Allam R., Pawar R.D. et al. Double-stranded RNA activates type I interferon secretion in glomerular endothelial cells via retinoic acid-inducible gene (RIG)-1 // Nephrol Dial Transplant. 2009. Vol. 24. N. 11. P. 3312-3318.
14. Allam R. Lichtnekert J., Moll A.G. et al.Viral RNA and DNA trigger common antiviral responses in mesangial cells // J Am Soc Nephrol. 2009. Vol. 20. N. 9. P. 1986-1996.
15. Малый В.П. (ред.). Герпесвирусная инфекция. М.: «Эксмо», 2009. 304 с.
16. Angel J., Franco M.A., Greenberg H.B. et al. Lack of a role for type I and type II interferons in the resolution of rotavirus-induced diarrhea and infection in mice // J. Interferon Res. 1999. N. 19. P. 655 – 659.
17. Жибурт Е.Б., Серебрянская Н.Б, Каткова И.В. и др. О механизмах активации цитомегаловирусной инфекции // Тер. архив. 1997. № 11. С. 40 – 41.
18. Никонов А.П., Асцатурова О.Р. Цитомегаловирусная инфекция и беременность // Гинекология. 2007. Т. 9, № 1, С. 49-52.
19. Гришаева О.Н. Маркеры цитомегаловирусной инфекции у детей с онкогематологическими заболеваниями // НОВОСТИ «Вектор-Бест». 1998. № 8. С. 18-20.
20. Учайкин В.Ф., Нисевич Н.И., Шамшева О.В. Инфекционные болезни и вакцинопрофилактика у детей М.: «ГЭОТАР-Медиа», 2006. 688с.
21. Малашенкова И. К., Дидковский Н. А., Сарсания Ж. Ш. и др. Клинические формы хронической Эпштейн—Барр-вирусной инфекции: вопросы диагностики и лечения // Лечащий врач. 2003. № 9. С. 32-38.
22. Yu Z., Manickan E., Rouse B.T. Role of interferon-gamma in immunity to herpes simplex virus // J. Leukoc. Biol. 1996. N. 60. P. 528 – 532.
23. Зайцева О. В., Зайцева С. В. Лечение и профилактика острых респираторных инфекции у часто болеющих детей // Лечащий врач. 2008. №8. С. 53-57.
24. Таболин В.А., Бельмер С.В., Османов И.М. (под ред.). Нефрология детского возраста: практическое руководство по детским болезням. М.: «ИД МЕДПРАКТИКА-М», 2005. 712 с.