А.В.Молочков,
МОНИКИ им.М.Ф.Владимирского
Генитальная папилломавирусная инфекция (ПВИ) является одной из самых частых инфекций, передаваемых половым путем (ИППП). Только в США ею поражено около 20 млн и ежегодно заражается 5,5 млн человек /16/. Чрезвычайная опасность и важная социальная значимость этой инфекции обусловлена ее этиологической ролью в развитии практически всех случаев рака шейки матки, около 50% других раков аногенитальной области, а также целого ряда разновидностей злокачественных новообразований верхних дыхательных путей и кожи /18, 23/.
В России, где официально регистрируются лишь случаи аногенитальных (венерических) бородавок, интенсивный показатель заболеваемости ими, составивший в 2004-2005 гг 32,9-32,1 случая на 100 тысяч населения, свидетельствует об эпидемическом характере распространенности этой категории ПВИ /5/. В то же время даже с учетом 10-кратного роста регистрируемой за последние 10 лет заболеваемости ПВИ /7/, эти цифры не отражают масштабов ее истинной распространенности. Во многом это связано со сложностью диагностики субклинических и латентных форм инфекции.
При половом заражении ВПЧ-инфекция чаще всего приводит к развитию аногенитальных бородавок, классической формой которых являются остроконечные кондиломы — доброкачественные мягкие папилломатозные разрастания, расположенные, как правило, в аногенитальной области и обычно обусловленные ВПЧ-6 и 11 и реже другими, в том числе высокоонкогенными, типами ВПЧ. В целом же не менее 35 типов ВПЧ (16,18 и др.) вызывают дисплазию и рак половых органов (шейки матки, вульвы, влагалища, полового члена), гортани и заднего прохода /3/.
Пик частоты ВПЧ-инфекции гениталий приходится на 18-25 лет- возраст наивысшей половой активности. После 30 лет ее распространенность снижается, но существенно возрастает частота дисплазий и рака шейки матки, причем пик частоты последнего приходится на 45 лет.
К числу важных в эпидемиологическом и клиническом отношении особенностей ПВИ-инфекции, наряду с ее нередким субклиничексим течением, являются длительность инкубационного периода (от нескольких месяцев до нескольких лет), что также существенно затрудняет ее диагностику и лечение /11/.
ВПЧ относятся к роду А семейства паповавирусов (Papovaviridae). Вирионы не имеют оболочки, диаметр их равен 50-55 нм. Геном представлен двуспиральной кольцевидно скрученной ДНК, включает около 8000 основных пар и кодирует всего 8 открытых рамок считывания. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов. Ранние белки (“early”), контролирующие репликацию вируса, транскрипцию и клеточную трансформацию, кодируются онкопротеинами Е6 и Е7. Поздние белки (“late”) L1 и L2 кодируют структурные белки вириона. Белок L1 формирует капсомеры. Белки Е1 и Е2 регулируют репликацию вирусной ДНК и экспрессию генов. Онкогены Е6 и Е7 всегда выявляются в опухолевых клетках зараженных ВПЧ, в то время как другие фрагменты вирусного генома могут быть утеряны в процессе его длительной персистенции.
В инфицированных эпителиальных клетках на начальных стадиях вирусный генетический материал персистирует в эписомальной форме, при этом клетка способна продуцировать вирусные частицы. На более поздних стадиях геном вируса интегрирует в клеточный геном, и способность к репродукции вируса утрачивается. Интеграция вирусной ДНК в клеточную может индуцировать несколько важных событий. Во-первых, она часто сопровождается потерей вирусного материала, при этом обязательно обеспечивается сохранение генов Е6 и Е7; во-вторых, независимо от делеций вирусный геном в интегрированной форме не способен к полной репликации; в-третьих, индуцируется нестабильность клеточного генома. Так, показано, что в канцерогенез шейки матки вовлечены определенные участки хромосом, что указывает на множественность генетических нарушений в опухолевой клетке. При интеграции вирусного генома в клеточный не только сохраняется транскрипция вирусных генов, прежде всего Е6 и Е7, но и активируется транскрипция некоторых клеточных генов.
Обнаружениe существенных различий в спектре синтезируемых этой опухолью РНК, указывает на разнообразие генетических механизмов, вовлеченных в процесс канцерогенеза, обусловленного ВПЧ. в частности, белки Е6 и Е7 могут инактивировать белки-супрессоры опухолевого роста р53 и рRb105 соответственно. Кроме того, указанные онкобелки влияют на некоторые белки-циклины и циклин-зависимые киназы, являющиеся регуляторами цикла деления клетки /15, 22/.
В настоящее время доказано, что ВПЧ является онкогенным вирусом, связанным не только с цервикальными и аногенитальными раками, но и с плоскоклеточным раком гортани, предстательной железы, кожи /1/ и др. (особенно на фоне иммуносупрессии).
Чаще всего в ткани генитальных опухолей обнаруживаются ВПЧ-6,11,16,18,31,33,35,41,42, причем у одного больного может быть несколько типов ВПЧ одновременно. ВПЧ инфицирует пролиферирующие эпителиальные клетки базального слоя эпителия через механические, бактериальные и другие микроповреждения.
Репликация ДНК ВПЧ происходит только в клетках базального слоя, поэтому методы лечения, направленные на удаление поверхностного слоя эпидермиса, неэффективны и сопровождаются рецидивом заболевания. Инфицированные клетки базального слоя служат постоянным источником инфицирования эпителиальных клеток, проходящих затем последовательные стадии дифференцировки с персистирующим репликативно неактивным вирусом.
После инфицирования ВПЧ в клетках эпидермиса нарушается нормальный процесс дифференцировки, особенно это касается клеток шиповатого слоя, в котором наблюдается клональная экспансия инфицированных ВПЧ клеток базального слоя, прошедших только первичную стадию дифференцировки. Эта клональная экспансия связана с их трансформацией и последующей иммортализацией. Трансформация и иммортализация клеток эпидермиса контролируется генами ВПЧ, кодирующими ранние (early) белки Е6 и Е7. При этом наблюдается деформация внутренних слоев эпидермиса и утолщение кожи, а клетки шиповатого слоя при переходе в зернистый оказываются наиболее активными в синтезе ДНК. Эта фаза жизненного цикла ПВИ включает 2-й этап репликативной дессиминации вируса внутри эпидермиса, в результате чего значительно поражается зернистый слой эпидермиса, при отсутствии экспрессии поздних (late) генов L1и L2. Последняя, как показано, наступает на конечной стадии дифференцировки в ороговевающем слое, где и наблюдается активная сборка зрелых вирусных частиц, их выделение из клетки и почкование прямо на поверхности кожи. Именно эти участки кожи инфекционно опасны в отношении контактного заражения.
Иммунный ответ хозяина играет важную роль в предотвращении клинической манифестации ВПЧ-инфекции. ВПЧ вызывает как гуморальный, так и клеточный типы иммунного ответа. Клеточный иммунитет, особенно Т-клеточная иммунная система, играет основную роль как в персистенции очагов ПВИ, так и в их спонтанном регрессе, который имеет место в 90% cлучаев и может наступить через 6-8 месяцев после начала заболевания.
Роль иммунных нарушений в патогенезе ВПЧ-инфекции подтверждается данными о более высокой частоте ВПЧ-ассоциированных заболеваний у реципиентов трансплантата внутренних органов /12/ и ВИЧ-инфицированных /20/, обнаружении нарушения Т-клеточного иммунитета у больных с генитальными бородавками, снижении количества клеток Лангерганса в очагах цервикальной интраэпителиальной неоплазии, а также большим количеством CD4+ и CD8+ Т-лимфоцитов в инфильтрате регрессирующих генитальных бородавок /21/, предотвращении ВПЧ-инфицирования экспериментальных животных и развития у них опухолевого процесса после иммунизации неструктурными белками ВПЧ (Е6 и Е7) /14/.
Важная роль клеточного звена иммунитета в патогенезе ВПЧ-инфекции также подтверждается данными о полной ремиссии ВПЧ-ассоциированных заболеваний после специфической стимуляции Т-клеточного иммунного ответа на гиперэкспрессию онкобелков Е6 и Е7 (гиперэкспрессия онкобелков Е6 и Е7 на клеточной поверхности возникает при интеграции ВПЧ в геном клетки) /8, 19/.
В этой связи важно отметить, что онкобелки Е6 и Е7 довольно иммуногены, хорошо распознаются Т-лимфоцитами и проявляют свой эффект через формирование комплексов со специфическими белками — р53 и Rb, которые обычно выполняют в клетке противоопухолевую функцию. У вирусов с высоким онкогенным потенциалом комплексы “Е6-р53” и “Е7-Rb” более стабильны, а инфицированные вирусом клетки неотвратимо становятся раковыми.
Клинически выделяют 4 типа генитальных бородавок.
1. Остроконечные кондиломы – наиболее частая разновидность генитальных бородавок.
Это мягкие папилломатозные фиброэпителиальные разрастания, по внешнему виду напоминающие цветную капусту, часто с мацерированной поверхностью, поражающие, как правило, слизистые оболочки (головка полового члена, наружное отверстие уретры, внутренний листок крайней плоти, малые половые губы, вход во влагалище, шейку матки, анус и анальный канал), реже – ороговевший эпителий (паха, промежность, перианальная область). На слизистых оболочках они более плоские. При гистологическом исследовании роговой слой состоит из паракератотических клеток, зернистый слой отсутствует. Эпидермис в состоянии акантоза и резко выраженного папилломатоза с утолщением и удлинением ветвящихся эпителиальных выростов; характерна вакуолизация верхних слоев эпидермиса. Дерма резко отечная, сосуды ее расширены; отмечаются очаговые воспалительные инфильтраты. В ряде случаев остроконечные кондиломы могут трансформироватьтся в гигантскую кондилому Бушке –Левенштейна.
2. Кератотические бородавки – папулы, имеющие роговой вид и часто напоминающие цветную капусту или себорейный кератоз, обычно располагающиеся на коже ствола полового члена, мошонки, половых губ, паховых складок.
3. Папулезные бородавки — куполообразные папулы диаметром от 1 до 4 мм с гладкой поверхностью (менее роговой, чем кератотические), имеющие цвет сырого мяса и располагающиеся на коже, покрытой полностью ороговевшим эпителием.
4. Плоские бородавки — пятнистые элементы или слегка приподнятые папулы, обычно невидимые невооруженным глазом, располагающиеся на фоне частично или полностью ороговевшего эпителия.
Без лечения генитальные бородавки могут спонтанно инволюцировать (в 90% случаев), длительно персистировать или увеличиваться в размере и количестве, трансформируясь в рак (10%). Рак in situ без лечения переходит в инвазивный рак в 36% случаях за 3,8-5,7 лет /18/. С меньшей частотой спонтанной инволюции подвергаются более длительно существующие очаги поражений. Отсутствие спонтанной инволюции генитальных бородавок также может быть связано с повторным инфицированием новыми типами ВПЧ. Реинфекция же одним и тем же типом ВПЧ, встречается не часто, возможно благодаря приобретенному иммунитету.
Прогноз генитальных бородавок зависит от типа обусловливающих их ВПЧ, сопутствующих заболеваний (включая ИППП). Если ВПЧ-16 обычно приводит к развитию плоскоклеточного рака, то ВПЧ-18 — к развитию аденокарценомы шейки матки — формы рака с очень плохим прогнозом. Плохим прогностическим факторам является и молодой возраст пациентки /10/.
Для выявления ВПЧ-инфекции чаще всего применяются молекулярно-генетические методы: неамплификационные (дот-блот, саузерн-блот гибридизация, гибридизация in situ на фильтре и ткани) и амплификационные (ПЦР и Hybrid Capture(HC)-анализ). При сравнении эффективности методов цервикальной цитологии и ПЦР в обнаружении ВПЧ-инфекции установлено, что ПЦР-метод является более чувствительным, чем цитологический.
В то же время ценность ВПЧ-типирования в клинической практике все еще не совсем ясна. Во всяком случае, положительные результаты не являются определяющими в предсказании исхода этой инфекции. Это связано как с возможностью технических ошибок при выявлении ВПЧ высокого риска, так и с необходимостью тщательного наблюдения за лицами с обнаруженными у них ВПЧ среднего и высокого риска, поскольку клинические и гистологические признаки ВПЧ-инфекции развиваются через 1-8 месяцев после первоначальной экспозиции вируса и даже нелеченные элементы могут регрессировать спонтанно, длительно существовать как доброкачественные или прогрессировать в предраковые поражения и рак.
Для использования в скрининге и мониторинге терапии тестирования на ДНК ВПЧ и для уверенности в надежности результатов используемый тест должен отвечать ряду требований. Это выявление широкого спектра генотипов ВПЧ высокого онкогенного риска (не менее 10 высоко распространенных) и невыявление низкоонкогенных типов ВПЧ, снижающих специфичность исследования. Кроме того, важной задачей ВПЧ-теста является возможность определения вирусной нагрузки. При этом выявление вируса в количестве, не превышающем порогового, имеет малое клиническое значение, так как говорит о высокой вероятности спонтанного излечения. При этом как положительные должны учитываться только случаи вирусной нагрузки, превышающей порог. В то же время при послеоперационном мониторинге введение порога неоправданно, поскольку выявление вируса даже с низкой нагрузкой может быть маркером рецидива /9/.
Несмотря на то, что генитальные бородавки редко персистируют, а тем более увеличиваются в размере и количестве и обычно регрессируют спонтанно, выраженный онкогенный потенциал целого ряда типов ВПЧ, особенно в условиях иммуносупрессии, ставит проблему лечения гениталынх бородавок в разряд весьма актуальных проблем современной медицины.
Исходя из биологических особенностей ПВИ, помимо удаления генитальных бородавок большое внимание должно быть уделено лечению субклинической и латентно протекающих ВПЧ-инфекции. Кроме того, решающее значение для предотвращения рецидива и приостановления процесса канцерогенеза имеет элиминация ВПЧ.
В настоящее время эффективность различных методов лечения генитальных бородавок, даже с учетом проведения повторных курсов, составляет 60-80% /13/. Рецидивы в 25-50% случаев наступают в течение первых 3-х месяцев после лечения и чаще всего обусловлены реактивацией вируса.
Поскольку в большинстве случаев больные с генитальными бородавками страдают и другими ИППП, их половые партнеры должны быть также соответствующим образом обследованы, в том числе на ВПЧ и ВИЧ-инфекции. Лечение генитальных бородавок, как и других ИППП, следует проводить обоим половым партнерам, причем в период его проведения им следует воздерживаться от половой жизни. После окончания лечения необходима барьерная контрацепция в сроки до 6 месяцев.
При разработке стратегии лечения важно учитывать возраст больного, локализацию, количество элементов, площадь очагов поражения, частоту рецидивов, наличие сопутствующей соматической патологии (в том числе урогенитальных инфекций), переносимость метода лечения, а также клинический опыт врача.
Наиболее часто применяются следующие методы лечения остроконечных кондилом.
1. Физические методы:
- криодеструкция,
- электрокоагуляция,
- лазерная вапоризация;
2. Химическая цитодеструкция:
- подофиллотоксин,
- подофиллин,
- трихлоруксусная кислота;
3. Антивирусная и иммуномодулирующая химиотерапия:
- цидофовир,
- имиквимод,
- интерфероны-?2 и –?,
- блеомицин,
- 5-фторурацил,
- ретиноиды;
4. Фотодинамическая терапия:
- с внутривенным применением фотосенсибилизатора,
- с местным применением фотосенсибилизатора.
В большинстве случаев бывает достаточно криодеструкции, электрокоагуляции, лечения лучами лазера или фотодинамической терапии (ФДТ).
При распространенном, рецидивном процессе более эффективна комбинация местного и общего лечения. При этом обычно вначале проводится деструктивное лечение. Затем, в связи с тем, что латентная стадия жизненного цикла ВПЧ протекает в клетках базального слоя эпидермиса и физическими методами очаг поражения трудно удалить полностью (ДНК ВПЧ могут быть на расстоянии до 1 см от видимых границ опухоли), сразу после регенерации эпидермиса, во избежание рецидива, осуществляется противовирусная терапия препаратами интерферона или кремом имиквимод. В случае рецидива применяют антивирусные и иммунотропные препараты.
Все интерфероны (ИФН) эффективны в отношении ВПЧ. При остроконечных кондиломах их применяют (инъекции внутрь очага или системно) в качестве терапии резерва, особенно при отсутствии эффекта от общепринятой терапии. ИНФ – это цитокины первой фазы иммунного ответа, обладающие антивирусными, антипролиферативными и иммуностимулирующими свойствами благодаря способности усиливать цитотоксическую активность Т-лимфоцитов и стимулировать их способность уничтожать клетки с измененной антигенной структурой.
Как известно, большинство вирусов индуцирует синтез интерферонов (ИНФ-? и ИНФ-?), обладающих выраженной противовирусной и иммуномодулирующей активностью. В клинической практике при лечении ВПЧ-ассоциированных заболеваний широко используется интерферон-?2.
Внутриочаговые инъекции под основание генитальных бородавок проводят препаратами ИНФ-?2 в дозе 5 млн. МЕ 3 раза в неделю в течение 3 недель. ИФН применяют также с целью предварительной терапии крупных очагов поражения для уменьшения их площади перед деструктивным методом, а также с целью профилактики рецидивов /17/.
Необходимо отметить техническую трудность проведения местного обкалывания генитальных бородавок, выраженный гриппоподобный синдром при парентеральном введении интерферона, а также выраженную болезненность при проведении таких манипуляций.
Подобных недостатков лишен препарат рекомбинантного интерферона-?2 «виферон». В его состав входят мембраностабилизирующие препараты – антиоксиданты – витамины Е и С в терапевтически эффективных дозах. Это усиливает противовирусную и иммуномодулирующую активность препарата в 10-14 раз по сравнению с препаратом интерферона-?2b реафероном /2/. Применение его позволяет снизить суточную дозу интерферона при однократном введении и пролонгировать его действие. Лекарственная форма препарата – ректальные суппозитории также обеспечивает уменьшение побочных реакций, характерных для парентерального введения препаратов интерферона, таких как повышение температуры, гриппоподобный синдром; и, кроме того, придает препарату новые фармакокинетические свойства: при сравнении титров интерферона в сыворотке крови здоровых добровольцев при внутривенном, внутримышечном и ректальном с антиоксидантами введении рекомбинантного интерферона-?2b, отмечено, что при введении 1 млн. МЕ интерферона ректально, титр интерферона в сыворотке крови превышал таковой при внутривенном или внутримышечном введении 2 млн. МЕ интерферона /4/. Существенно, что даже при длительном применении виферона (в течение 2 лет) не образуется антител, нейтрализующих антивирусную активность интерферона- ?2b /6/.
При лечении эндоуретральных кондилом используют ежедневные инстилляции ИФН-?2 в дозе 25 млн. МЕ в течение 6 нед. и цитологическим контролем через 2 и 6 нед. после окончания курса лечения, а затем — каждые 3 мес. в течение года. Рецидив служит показанием к проведению повторного курса лечения /17/.
По нашему мнению для лечения эндоуретральных кондилом наиболее оправдано использование геля «виферон». Основной компонент препарата – человеческий рекомбинантный интерферон альфа-2 обладает выраженным противовирусным действием. Природный антиоксидант – витамин Е и его синергисты – бензойная и лимонная кислоты, метионин – способствуют стабилизации клеточных мембран, обладают ранозаживляющим действием. Гелевая основа обеспечивает пролонгацию воздействия препарата, а вспомогательные вещества – стабильность специфической активности и надлежащую микробиологическую чистоту препарата.
Под нашим наблюдением находилось 18 пациентов (12 мужчин и 6 женщин) с диагнозом остроконечные кондиломы аногенитальной области. Возраст пациентов варьировал от 19 до 38 лет, и в среднем составлял 24,7 года. Для идентификации типа ВПЧ в каждом случае проводилась ПЦР, необходимо отметить, что наиболее часто выявлялись ВПЧ 6, 11, 31 и 33 типов, при этом в группе женщин из 6 пациенток у 5 был выявлен ВПЧ 6 типа. Все пациенты ранее неоднократно проходили лечение по поводу остроконечных кондилом с применением различных методов деструкции: электрокоагуляция, криодеструкция, лазерная вапоризация и др. В среднем количество рецидивов составляло 2,8, при этом средний межрецидивный период составлял 2,1 месяца, и ни в одном случае его продолжительность не превышала 4 месяцев.
Всем пациентам проводился 14-дневный курс терапии ректальными суппозиториями «виферон» по 3 млн МЕ в сутки, местно применялся гель «виферон». На 15 день проводилась деструкция новообразований методом электрокоагуляции, после чего рекомендовалось продолжить применение ректальных суппозиториев «виферон» по 1 млн МЕ в сутки в течение еще 15 дней. Ближайшие результаты лечения в каждом случае были хорошими (рис. 1, 2). В период наблюдения не менее 8 месяцев рецидивов заболевания не было отмечено ни в одном случае. Особо необходимо отметить хорошую переносимость применявшихся препаратов: побочных эффектов или осложнений не было отмечено ни в одном случае.
Полученные результаты позволяют рассматривать виферон как эффективный препарат для иммунотерапии ВПЧ-ассоциированных генитальных неоплазий и рекомендовать его широкое внедрение в практику специалистов.
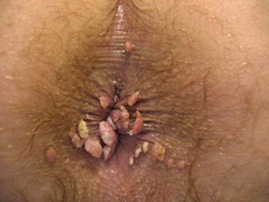
Рис. 1 Больной К, 27 лет остроконечные кондиломы в перианальной области
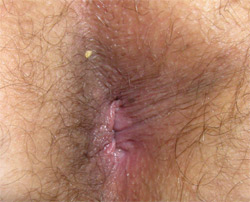
Рис. 2 Тот же больной, через 5 дней после окончания курса лечения
Литература
1. Давыдов М., Демидов Л., Поляков В. Современное состояние и проблемы онкологии //Врач-2007.-№13.-С.3-7.
2. Деленян Н.В., Ариненко Е.Н., Мешкова Е.Н. и др. Виферон // Руководство для врачей под ред. В.В.Малиновской М. 1997.
3. Дмитриев Г.А., Биткина О.А. Папилломавирусная инфекция.-М. «Медицинская книга»-2006.
4. Джуминго П.А. Интерферонообразование и продукция специфических антител в процессе комбинированной терапии реафероном и антиоксидантами у больных простым рецидивирующим герпесом // Дисс… канд. мед. наук М. 1990.
5. Евстигнеева Н.П. Папилломавирусная инфекция урогенитального тракта женщин: эпидемиология, факторы персистенции, оптимизация ранней диагностики и профилактики онкогенеза //Автореф. дис ..докт. мед. наук.-М.,2007.
6. Ершов Ф.И. Система интерферона в норме и при патологии // М., Медицина 1996.
7. Киселев В.И. Вирусы папилломы человека в развитии рака шейки матки, -Димитрейд График Групп- М.- 2004.
8. Киселев В.И., Киселев О.И. Вирусы папилломы человека в развитии рака шейки матки-С.-Пб.-М.,2003.
9. Куевда Д.А. Современная концепция диагностики папилломавирусной инфекции// Тез. докл. Межрегиональной научно-практической конференции «Дерматовенерология в период реформирования здравоохранения и реализации национальных проектов»-Екатеринбург, 22-23 мая 2007-C.112-113.
10. Мазуренко Н.Н. Роль вирусов папилломы в канцерогенезе шейки матки //Современая онкология-2003.№1.-С.7-10.
11. Allen AL, Siegfried EC. What’s new in human papillomavirus infection. Curr Opin Pediatr 2000;12:365-9.
12. Benton С., Shahidullah H., Hunter J.A.A. Hu¬man papillomavirus in the immunosuppressed // Papillomavirus Rep.- 1992.-Vol. –P.23-26.
13. Berman B., Ramires C.C. Anogenital warts/Treatment of Skin Disease/ Compehansive therapeutic strategies /Ed. M.G.Lebwohl et al.-2nd ed.-2006.-Mosbi –P.47-49.
14. Brandsma J.L. Animal models for HPV vaccine development // Papillomavirus Rep.-1994.-Vol. 5.-P.105-111.
15. Greenfield I., Cutill S., Antivirals/ Human papillomavirus.Clinical and scientific advances/ Ed. J.C.Sterling& S.K.Tyring-london: Arnold-2001.-P.1120-1130.
16. Kirnbauer R., Lenz P., Okun M.M. Human papilllomavirus/In/ Dermatology-/Ed/ J.L.Bolognia et al.-Edinburg-Mosby-2002.-P.-1217-1234.
17. Koutsky L.A., Kiviar N.B. Genital human papilomavirus. In: Sexual Transmitted Diseases/ Ed. K. K. Holmes et al. –3rd ed.- Mc.Growhill.,1999.- New York,-P.347-360.
18. Munoz N. Human papillomavirus and cancer: the epidemiological evidence //J.Clin. Virol.-2000.-Vol.19.-P.1-90.
19. Munger K., Howley P.M. Human papillomavirus immortalization and transformation functions //Virus Res.-2002.-Vol.89.-P.213.
20. Palefski J.M. Anal sguamous cell intraepithelial lesions: relation to HIV and human papillomavirus infection //J.Acquir.Immun. Defic. Syndr.-1999.-Vol.21(Suppl. ).-Р.42-48.
21. Tagami H. Regression phenomenon of nu¬merous Hat wars — An experiment on the nature of tumor immunity in man // Int. J. Dermatol .- 1983.-Vol. 22.-P.570-571.
22. Wiley D.J., Douglas J., Beutner K. et al. External gеnital warts: diagnosis, treatment? And prevention //Clin. Inf. Dis.-2002.-Vol.35,-P.210-224.
23. zur Hauzen H. Papillomavirus infection- a major cause of human cancer //Byochem. Biophys. Acta-1996.0-Vol.1288.-F.55-F.78.




