Э.Н. Симованьян, В.Б. Денисенко
Ростовский государственный медицинский университет, г. Ростов-на-Дону, РФ
Цель исследования – совершенствование лечения острого обструктивного бронхита (ООБ) у детей раннего возраста с использованием рекомбинантного интерферона-?2b в сочетании с высокоактивными антиоксидантами витаминами Е и С (ВИФЕРОН). Материалы и методы исследования: проведено клиническое и иммунологическое обследование 52 больных
ООБ, ассоциированного с ОРВИ, в возрасте от 1 до 3 лет. Стандартную терапию назначали 25 больным. У 27 пациентов помимо стандартной терапии использовали рекомбинантный интерферон-?2b (ВИФЕРОН). Результаты: заражение вирусами респираторной группы детей с отягощенным преморбидным фоном приводило к нарушению эффекторного этапа иммунного ответа по клеточному и гуморальному типам, формированию воспаления в стенке бронхов и появлению клинической симптоматики ООБ в виде общеинфекционного, катарального и бронхообструктивного синдромов. Назначение рекомбинантного интерферона-?2b в сочетании с антиоксидантами витаминами Е и С (ВИФЕРОН) способствовало подавлению репликации респираторных вирусов, поляризации регуляции иммунного ответа по Th1-типу, положительной динамике показателей эффекторного этапа иммунного ответа по клеточному и гуморальному типам, сокращению продолжительности симптомов заболевания и госпитализации пациентов. Заключение: высокая эффективность рекомбинантного интерферона-?2b в сочетании с высокоактивными антиоксидантами витаминами Е и С (ВИФЕРОН) позволяет рекомендовать широкое использование этого препарата при лечении ООБ, ассоциированного с ОРВИ, у детей раннего возраста.
Ключевые слова: острый обструктивный бронхит, острые респираторные вирусные инфекции, дети раннего возраста, рекомбинантный интерферон-?2b.
Цит.: Э.Н. Симованьян, В.Б. Денисенко. Совершенствование терапии острого обструктивного бронхита, ассоциированного с ОРВИ, у детей раннего возраста. Педиатрия. 2018; 97 (1): 65–70.
IMPROVING THE THERAPY OF ACUTE OBSTRUCTIVE BRONCHITIS OF VIRAL ETIOLOGY IN INFANTS
ООО ФеронE.N. Simovanyan, V.B. Denisenko
Rostov State Medical University, Rostov-on-Don, Russia
Контактная информация:
Симованьян Эмма Никитична – д.м.н., проф., зав. каф. детских инфекционных болезней Ростовского государственного медицинского университета
Адрес: Россия, 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29 Тел.: (863) 232-73-58, Email: detinfrostov@gmail.com
Статья поступила 12.12.17, принята к печати 20.01.18.
Contact Information:
Simovanyan Emma Nikitichna – MD., prof., head of Pediatric Infectious Diseases Department, Rostov State Medical University
Address: Russia, 344022, Rostov-on-Don Nakhichevanskiy per., 29 Теl.: (863) 232-73-58, Email: detinfrostov@gmail.com
Received on Dec. 12, 2017, submitted for publication on Jan. 20, 2018.
Objective of the research – to improve the treatment of acute obstructive bronchitis in infants using recombinant interferon ?2b in combination with highly active antioxidants vitamins E and C (VIFERON). Study materials and methods: сlinical and immunological examination of 52 patients aged 1–3 years with acute obstructive bronchitis of viral etiology was performed. Standard therapy was prescribed to 25 patients. In 27 patients, in addition to standard therapy, recombinant interferon ?2b (VIFERON) was used. Results: infection with respiratory group viruses of children with a burdened premorbid background led to immune response effector stage disorder by cellular and humoral types, inflammation in the bronchial wall formation andclinical symptoms of acute obstructive bronchitis in the form of general infectious, catarrhal and bronchial obstructive syndromes. Recombinant interferon ?2b in combination with antioxidants vitamins E and C (VIFERON) contributed to the suppression of respiratory virus replication, the polarization ofimmune response by Th1 type regulation, positive dynamics of immune response effector stageby cellular and humoral types, shortening the duration of disease symptoms and hospitalization of patients. Conclusion: high efficiency of recombinant interferon ?2b in combination with highly active antioxidants vitamins E and C (VIFERON) allows the wide use of this drug in treatment of acute obstructive bronchitis of viral etiology in infants.
Keywords: acute obstructive bronchitis, infants, recombinant interferon ?2b.
Quote: E.N. Simovanyan, V.B. Denisenko. Improving the therapy of acute obstructive bronchitis of viral etiology in infants. Pediatria. 2018; 97 (1): 65–70.
Проблема острого обструктивного бронхита (ООБ) относится к наиболее актуальным вопросам в современной педиатрии. Это связано прежде всего с высоким уровнем заболеваемости, которая составляет 4500–7500/100 тыс детского населения [1, 2]. ООБ имеет преимущественно вирусную этиологию и относится к заболеваниям раннего возраста – его переносят от 25 до 30% детей первых 3 лет жизни [2, 3]. ООБ характеризуется тяжелым течением, достаточно частым развитием осложнений и неотложных состояний, является причиной госпитализации 5–40% детей раннего возраста [1, 4, 5]. На высоком уровне остается летальность при ООБ – 1–2% [1, 3, 4]. У 10–50% реконвалесцентов в дальнейшем диагностируют рецидивирующий обструктивный бронхит или происходит трансформация в бронхиальную астму [2, 5].
В настоящее время внимание ученых направлено на разработку методов лечения ООБ у детей [1, 4]. Следует отметить, что применяемые схемы терапии не всегда оказываются эффективными, что приводит к развитию осложнений, летальным исходам, формированию рецидивирующего обструктивного бронхита и бронхиальной астмы [6–8]. В связи с этим перспективным направлением совершенствования терапии представляется включение в комплекс лечения ООБ, ассоциированного с ОРВИ, рекомбинантного интерферона-?2b в сочетании с высокоактивными антиоксидантами витаминами Е и С (рИФН-?2b, ВИФЕРОН, VIFERON, производство ООО «Ферон», Москва, Россия). Достоинствами препарата являются широкий спектр противовирусной активности, иммуномодулирующее и цитопротективное действие [7]. Входящий в состав препарата рИФН-?2b тормозит репликацию вирусов за счет активации эндонуклеазы, разрушения матричной РНК и нарушения синтеза вирусных белков [7, 8]. Кроме того, рИФН-?2b обладает иммунокорригирующей активностью – стимулирует выработку цитокинов, модулирует иммунный ответ по клеточному типу, способствует дифференцировке В-лимфоцитов, повышает функциональную активность макрофагов, нейтрофилов и естественных киллерных клеток [7–9]. Входящие в состав рИФН-?2b (ВИФЕРОН ) природные антиоксиданты (витамины Е и С) стабилизируют клеточные мембраны, что способствует усилению фармакологической активности рИФН-?2b [7]. Использование препарата в форме ректальных свечей позволяет добиться более высокого содержания и длительной циркуляции рИФН-?2b в крови по сравнению с парентеральным способом введения.
Препарат успешно используют в составе комплексной терапии при различных инфекционных заболеваниях у детей, в т.ч. при острых респираторных инфекциях, гриппе, пневмонии, менингите, сепсисе, внутриутробных инфекциях, инфекции простого герпеса, острой и хронической Эпштейна–Барр вирусной инфекции, цитомегалии, микоплазмозе, дифтерии, шигеллезе, хронических вирусных гепатитах В, С, D у детей [7]. Помимо отчетливого клинического эффекта отмечены усиление синтеза ИФН?, активация макрофагов, нейтрофилов, естественных киллерных клеток, повышение количества и функциональной активности Т-лимфоцитов, нормализация показателей гуморального иммунитета [10–15].
Цель исследования – совершенствование лечения ООБ, ассоциированного с ОРВИ, у детей раннего возраста с использованием рекомбинантного интерферона-?2b в сочетании с высокоактивными антиоксидантами витаминами Е и С (ВИФЕРОН ).
Материалы и методы исследования
Под нашим наблюдением находились 52 ребенка в возрасте 1–3 лет, поступившие в стационар по поводу ООБ, ассоциированного с ОРВИ. От родителей было получено информированное согласие на участие пациентов в исследовании. Локальный независимый этический комитет Ростовского государственно медицинского университета одобрил выполнение данного исследования (протокол № 2 от 08.02.2017 г.). Анализ этиологической структуры заболевания с использованием полимеразной цепной реакции (ПЦР, тест-системы «Амплисенс», Россия) смывов из носоглотки показал, что причиной служили респираторно-синцитиальный вирус (25%), вирусы парагриппа (11,5%), гриппа (5,8%), аденовирусы (5,8%), энтеровирусы (5,8%) и смешанная вирусная инфекция (46%).
Методом случайной выборки больные были рандомизированы на 2 группы. В 1-ю группу вошли 25 пациентов, которым назначали стандартную терапию, включавшую бронхоспазмолитические и муколитические препараты, ингаляции, топические глюкокортикоиды, по показаниям – антигистаминные, жаропонижающие и симптоматические средства. Дети 2-й группы (27 больных) помимо стандартной терапии получали рИФН-?2b (ВИФЕРОН ) по одной ректальной свече 150 000 МЕ 2 раза в день с интервалом в 12 ч в течение 10 дней. Обе группы оказались сопоставимыми по преморбидному фону, форме тяжести заболевания, клиническим, биохимическим и иммунологическим показателям до начала терапии.
Клиническое обследование включало анализ данных анамнеза и клинического осмотра в динамике заболевания. По показаниям назначали биохимическое исследование крови, рентгенографию органов грудной клетки, электрокардиографию и др. Иммунологическое обследование осуществляли при поступлении и при выписке из стационара (на 10–14-й день). Определение различных типов иммунокомпетентных клеток проводили методом непрямой иммунофлуоресценции с помощью моноклональных антител («Сорбент», Россия): для Т-лимфоцитов – CD3, для Т-хелперов – CD4, для цитотоксических Т-лимфоцитов – CD8, для непримированных («наивных») лимфоцитов – CD45RA, для В-лимфоцитов – CD20, для нейтрофилов, экспрессирующих рецепторы к С3d-компоненту комплемента – CD11b. Учет результатов осуществляли на лазерном проточном цитофлуориметре «Epix-XL Coulter» (США). Определение содержания в Т-хелперах внутриклеточных цитокинов ИФН? (Т-хелперы 1-го типа – Th1) и ИЛ4 (Т-хелперы 2-го типа – Th2) проводили методом мультипараметрической проточной цитофлуориметрии c использованием моноклональных антител к CD4, анти-ИФН? или анти-ИЛ4 соответственно (тест-системы «Caltag», США). Содержание иммуноглобулинов классов IgA, IgM и IgG в сыворотке крови изучали методом радиальной иммунодиффузии в геле по G. Manchini et al. (1965) с использованием моноспецифических сывороток производства «Имбио» (Россия). Содержание циркулирующих иммунных комплексов (ЦИК) в сыворотке крови исследовали методом их осаждения полиэтиленгликолем. Интенсивность кислородзависимого метаболизма нейтрофилов оценивали в спонтанном и стимулированном тесте восстановления нитросинего тетразолия (НСТ). Коэффициент стимуляции НСТ-теста высчитывали по следующей формуле: К ст.=НСТ ст./НСТ сп.
В качестве контроля использовали иммунологические показатели 15 детей I группы здоровья аналогичного возраста, у которых проводили забор крови для планового обследования на вирусные гепатиты.
Статистическую обработку результатов осуществляли с помощью пакета статистических программ «R». В связи с тем, что анализ рядов абсолютных показателей выявил несоответствие закону нормального распределения (р
Результаты и их обсуждение
Анализ анамнеза жизни выявил наличие групп риска у всех обследованных пациентов. У 59,6% матерей имела место патология периода беременности, в т.ч. гестоз – у 46,2%, угроза прерывания беременности – у 44,2%, анемия – у 23,1%, острые респираторные инфекции – у 21,2%, гестационный пиелонефрит – у 11,5%. Указание в анамнезе на осложненное течение родов имели 67,3% матерей: на стремительные роды – 23,1%, на слабость родовой деятельности – 40,4%, на кесарево сечение – 11,5%, на преждевременные роды – 25%. Задержка внутриутробного развития выявлена у 30,8% детей, перинатальное поражение ЦНС – у 48,1%, ранний перевод на искусственное вскармливание – у 40,4%, гипотрофия – у 28,8%, анемия – у 26,9%, частые острые респираторные инфекции – у 46,2%, перенесенные пневмонии – у 26,9%, перенесенные острые кишечные инфекции – у 48,1%, атопический дерматит – у 15,4% пациентов. Состояние преморбидного фона детей 1-й и 2-й групп достоверно не различалось.
Определение степени тяжести ООБ осуществляли по шкале A. Tal et al. (1983) [16]. Среднетяжелую форму ООБ диагностировали при сумме 5–8 баллов, тяжелую форму – при сумме 9–12 баллов. При клиническом обследовании установлено, что у более половины детей (55,8%) состояние расценено средней степени тяжести, у 44,2% – как тяжелое. У всех детей выявлено повышение температуры тела, у подавляющего большинства – до субфебрильных цифр (84,6%). Практически у всех больных (84,6%) имели место умеренные симптомы интоксикации (слабость, вялость, снижение аппетита и др.). У всех детей обнаружены катаральные симптомы по типу ринофарингита, при этом чаще имели место умеренные серозные выделения из носа (80,8%) и гиперемия слизистой оболочки ротоглотки (78,8%). Всех пациентов беспокоил кашель, который чаще был сухим (65,4%), реже – малопродуктивным влажным (34,6%). У 100% больных при объективном обследовании выявлена экспираторная одышка. Частота дыхательных движений у 63,5% детей составляла 40–60 в мин, у 36,5% – более 60 в мин. У всех детей имел место периоральный цианоз, в т.ч. при беспокойстве – у 17,3%, в покое – у 82,7%. У 100% пациентов наблюдалось участие вспомогательной мускулатуры в акте дыхания: при беспокойстве – у 17,3%, в покое – у 82,7% При аускультации у всех детей выслушивали рассеянные сухие свистящие хрипы, у 25% – крупно-, средне- и мелкопузырчатые влажные хрипы над всей поверхностью легких. У 13,5% больных имела место тахикардия. Достоверных различий показателей у пациентов 1-й и 2-й групп не выявлено (табл. 1).

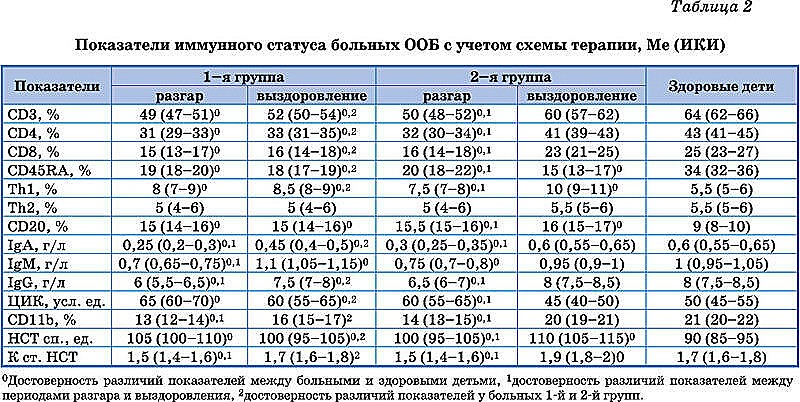
При первичном исследовании иммунного статуса у детей обеих групп выявлены сдвиги показателей, характеризующих различные этапы формирования иммунного ответа (табл. 2). Этап распознавания вирусных антигенов сопровождался уменьшением количества непримированных («наивных») CD45RA-лимфоцитов. На этапе регуляции выявлена поляризация регуляции иммунного ответа по Th1-типу, о чем свидетельствовало повышение количества этих клеток при нормальном содержании Th2. Отмечено существенное угнетение эффекторного этапа иммунного ответа по клеточному типу. Обнаружено снижение Т-лимфоцитов (CD3), Т-хелперов (CD4), цитотоксических Т-лимфоцитов (CD8), экспрессии рецептора к С3d-компоненту комплемента на нейтрофилах (CD11b), адаптационных возможностей кислородзависимого метаболизма этих клеток (К ст. НСТ) на фоне повышения его спонтанной активности (НСТ сп.). Кроме того, регистрировались нарушения эффекторного этапа гуморального иммунного ответа – на фоне повышения количества CD20-лимфоцитов имело место уменьшение содержания IgA, IgМ, IgG, увеличение уровня ЦИК. Достоверные различия между показателями больных 1-й и 2-й групп отсутствовали.
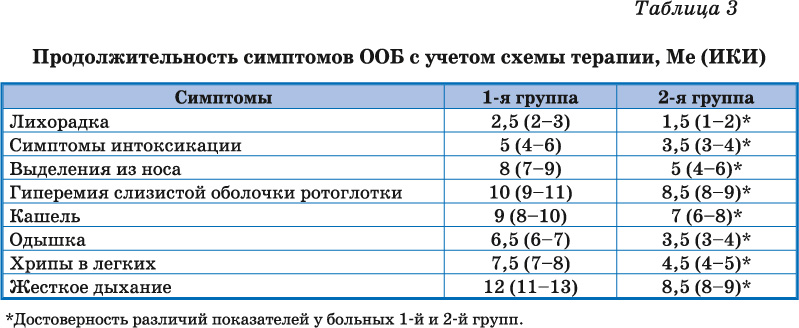
Обследование в динамике заболевания показало, что у детей, получавших рИФН-?2b (ВИФЕРОН ), отмечалось уменьшение продолжительности лихорадки, симптомов интоксикации, выделений из носа, гиперемии слизистой оболочки ротоглотки, кашля, одышки, сухих хрипов и жесткого дыхания в легких по сравнению с 1-й группой (табл. 3).
При динамическом исследовании показателей иммунного статуса установлено, что на фоне терапии рекомбинантным рИФН-?2b (ВИФЕРОН ), в отличие от 1-й группы, регистрировались отчетливые положительные сдвиги (табл. 2). Интенсивное распознавание вирусных антигенов приводило к дальнейшему уменьшению количества непримированных («наивных») CD45RA-лимфоцитов. Отмечалось преимущественное развитие иммунного ответа по клеточному типу, о чем свидетельствовало дальнейшее увеличение содержания Th1 на фоне стабильного количества Th2. Со стороны показателей, характеризующих эффекторный этап иммунного ответа по клеточному типу, наблюдалась нормализация содержания Т-лимфоцитов, Т-хелперов и CD8-клеток. Происходило восстановление показателей нейтрофильного звена – нормализация содержания CD11b-клеток, повышение интенсивности кислородзависимого метаболизма нейтрофилов (НСТ сп.) и возрастание его адаптационных возможностей (К ст. НСТ). Имела место положительная динамика показателей эффекторного этапа гуморального иммунного ответа в виде нормализации содержания IgA, IgМ, IgG и ЦИК. У пациентов 1-й группы динамика иммунного статуса была менее выраженной.
Побочные эффекты при использовании рИФН-?2b (ВИФЕРОН ) не отмечались.
Таким образом, результаты проведенного исследования свидетельствуют о том, что у детей раннего возраста с ООБ, ассоциированным с ОРВИ, имела место высокая частота групп риска в антенатальном периоде, ранее перенесенных инфекционных заболеваний, что свидетельствовало о фоновом иммунодефиците. В результате заражения вирусами респираторной группы происходило углубление иммунологических нарушений. У этих пациентов, по нашим данным, происходили распознавание антигенов, регуляция иммунного ответа преимущественно по клеточному типу с участием Th1. Вместе с тем отмечалось угнетение эффекторного этапа иммунного ответа по клеточному (снижение CD3-, CD4- и CD8-лимфоцитов, нарушения нейтрофильного звена) и гуморальному типам (гипогаммаглобулинемия за счет IgA, IgМ, IgG, повышение ЦИК). В результате происходило формирование очага воспаления в стенке бронхов, что являлось причиной появления клиники ООБ в виде общеинфекционного, катарального и бронхобструктивного синдромов.
Включение рИФН-?2b в сочетании с высокоактивными антиоксидантами витаминами Е и С (ВИФЕРОН ) в программу комплексной терапии ООБ на фоне ОРВИ или ассоциированного с ОРВИ способствовало модуляции иммунного ответа по клеточному типу. Отмечалась положительная динамика показателей эффекторного этапа иммунного ответа по клеточному и гуморальному типам. Комплексная противовирусная и иммуномодулирующая активность рИФН-?2b (ВИФЕРОН ) способствовала более быстрому, по сравнению со стандартной терапией, купированию воспаления в стенке бронхов, что документировано уменьшением продолжительности проявлений общеинфекционного, катарального и бронхообструктивного синдромов. Назначение рИФН-?2b (ВИФЕРОН ) являлось безопасным, хорошо переносилось больными и не приводило к развитию побочных эффектов
Выводы
- Заражение вирусами респираторной группы детей с отягощенным преморбидным фоном приводило к нарушению эффекторного этапа иммунного ответа по клеточному и гуморальному типам, формированию воспаления в стенке бронхов и появлению клинической симптоматики ООБ на фоне ОРВИ или ассоциированного с ОРВИ в виде общеинфекционного, катарального и бронхообструктивного синдромов.
- Назначение рИФН-?2b в сочетании с высокоактивными антиоксидантами витаминами Е и С (ВИФЕРОН ), помимо подавления репликации респираторных вирусов, способствовало преимущественной регуляции по Th1-типу, положительной динамике показателей эффекторного этапа иммунного ответа по клеточному и гуморальному типам, сокращению продолжительности симптомов заболевания и госпитализации пациентов.
- Высокая эффективность и безопасность рИФН-?2b (ВИФЕРОН ) позволяют рекомендовать широкое использование этого препарата при лечении ООБ на фоне ОРВИ или ассоциированного с ОРВИ у детей раннего возраста в составе комплексной терапии.
Конфликт интересов:
авторы статьи подтвердили отсутствие финансовой поддержки исследования, о которой необходимо сообщить.
Литература
- Мизерницкий Ю.Л. Дифференциальная диагностика и принципы дифференцированной терапии бронхообструктивного синдрома при острой респираторной инфекции у детей. Земский доктор. 2010; 3: 5–10.
- Воловик И.К. Дифференциальная диагностика бронхообструктивного синдрома у детей. Медицина критических состояний. 2013; 1: 125–128.
- Симованьян Э.Н., Плескачев А.Д., Бовтало Л.Ф., Денисенко В.Б., Колодяжная Н.М., Ловердо Р.Г., Рогозин П.Ф., Мартыненко Л.Д., Пустовалова Л.М. Инфекционные болезни у детей. Ростов-на-Дону: Феникс, 2007: 766.
- Таточенко В.К. Педиатру на каждый день. М.: Компания Боргес, 2016: 272 с.
- Садовникова И.В., Зудов А.В. Современные подходы к этиопатгенетической терапии бронхообструктивных заболеваний в педиатрической практике. Вестник новых медицинских технологий. 2015; 1: 27–32.
- Жукова О.В., Конышкина Т.М., Кононова С.В. Клиническая и экономическая составляющая симптоматической терапии острого обструктивного бронхита в условиях стационара. Фарматека. 2012; 15: 89–95.
- Дудник В.М. Новые возможности применения секретолитиков в комплексной терапии острого обструктивного бронхита у детей раннего возраста. Современная педиатрия. 2012; 2: 59–64.
- Симованьян Э.Н., Харабаджахян Э.А., Денисенко В.Б. Эффективность использования рекомбинантного интерферона-?2b (ВИФЕРОНА) при остром обструктивном бронхите у детей. Педиатрия. 2008; 87 (1): 106–114.
- Малиновская В.В., Чеботарева Т.А., Парфенов В.В. Клиническая эффективность применения препарата виферон при лечении гриппа и ОРВИ. Южно-Уральский медицинский журнал. 2014; 4: 32–39.
- Нестерова И.В., Ковалева С.В., Клещенко Е.И., Колесникова Н.В., Чудилова Г.А., Ломтатидзе Л.В., Шинкарева О.Н., Малиновская В.В., Выжлова Е.Н. Новые подходы к проведению интерфероно- и иммуномодулирующей терапии у иммунокомпрометированных детей с возвратными респираторными вирусными инфекциями. Лечащий врач. 2014; 4: 107–110.
- Чеботарева Т.А., Мазанкова Л.Н., Хоперскова А.П., Малиновская В.В., Кольцов В.Д., Брагина Г.С. Рекуррентные инфекции органов дыхания у детей и программы иммунореабилитации. Детские инфекции. 2014; 3: 61–64.
- Осидак Л.В., Образцова Е.В., Головачева Е.Г., Афанасьева О.И., Суховецкая В.Ф., Дриневский В.П., Киселева О.В., Павлова Е.Б. Виферон в терапии гриппа и других ОРИ вирусной и вирусно-бактериальной этиологии у детей. Детские инфекции. 2012; 1: 44–50.
- Шамшева О.В., Полеско И.В. Лечение интерферонами детей с внутриутробными инфекциями. Детские инфекции. 2014; 2: 43–47.
- Симованьян Э.Н., Денисенко В.Б., Сарычев А.М., Григорян А.В. Хроническая инфекция вируса Эпштейна–Барр у детей: современные аспекты диагностики и лечения. Педиатрия. Приложение к журналу Consilium medicum. 2006; 8 (2): 29–35.
- Симованьян Э.Н., Денисенко В.Б., Григорян А.В., Ким М.А., Бовтало Л.Ф., Белугина Л.В. Эпштейна–Барр вирусная инфекция у детей: совершенствование программы диагностики и лечения. Детские инфекции. 2016; 15 (1): 15–23.
- Tal A, Bavilski C, Yohai D, Bearman JE, Gorodischer R, Moses SW. Dexametasone and salbutamol in treatment of acute wheezing in infants. Pediatrics. 1983; 71 (1): 13–18.
Впервые опубликовано в журнале «Педиатрия им. Сперанского», 2018, т. 97, №1, С. 65–70, www.pediatriajoumal.ru




