Чеботарева Т.А., Мазанкова Л.Н.,Выжлова Е.Н., Каряева С.К.
Российская медицинская академия последипломного образования, Москва.
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, Москва.
Северо-Осетинская государственная медицинская академия, Владикавказ.
Более чем двухсотлетняя история вакцинопрофилактики убедила мировое сообщество в своей бесспорной эффективности. Однако, несмотря на довольно значительные успехи по снижению уровня инфекционной заболеваемости, при значительном разнообразии использующихся в настоящее время вакцин, ни одна из них не обеспечивает абсолютный профилактический и/или лечебный эффект. Проблема низкой эффективности вакцинации наиболее актуальна у взрослых и детей, имеющих отклонения в иммунной системе (часто болеюшие дети, лица с хронической патологией и различными иммунодефицитными состояниями). В связи с чем, именно для этой категории лиц наиболее важным направлением является поиск способов повышения эффективности вакцинации и усиления иммуногенных свойств вакцин [1,2,3]. Таким требованиям отвечают адъюванты, которые в последнее время начали использоваться как ключевой компонент оптимизации иммунного ответа при вакцинации.
Адъюванты (adjuvans – (лат.) помогающий, поддерживающий) представляют собой неспецифические иммуностимуляторы неорганической и органической природы. Впервые возможность повышения эффективности вакцины путем добавления к антигену различных веществ была прродемонстрирована в 1925 году французским ученым Гастоном Рамоном (Gaston Ramon). Именно Рамон ввел концепцию адьювантной поддержки вакцинации, обнаружив, что при иммунизации лошадей дифтерийным токсином более сильный иммунный ответ наблюдали у тех животных, у которых на месте введения вакцины возникала воспалительная реакция. Позднее в 1926 году А. Гленни с соавторами установили, что алюмопреципитация дифтерийного токсина значительно повышает его антигенные свойства [4,5,6]. Дальнейшие исследования возможности усиления иммуногенности вакцин путем преципитации белков различными металлами показали, что наилучший эффект и безопасность достигаются при использовании именно соединений алюминия [5,8].
На современном этапе, несмотря на то, что прошло более чем 80 лет с момента данного открытия, соли алюминия (гидроокись алюминия, фосфат алюминия, алюмокалиевые квасцы), по-прежнему остаются наиболее широко используемым вакцинными адъювантами. Вакцинный антиген адсорбируется на них посредством ионного взаимодействия, поэтому вакцины, приготовленные с такими традиционными адъювантами, принято называть адсорбированными или сорбированными. Считается, что в основе механизма действия вакцины, содержащей в качестве адъюванта соединение алюминия, лежит образование при парентеральном введении в месте инъекции воспалительных гранулем. Такая местная воспалительная реакция способствует повышению активности макрофагов, а образование фиброзной капсулы позволяет длительно сохранять антиген и препятствует его быстрому удалению [5,8]. Однако в случае быстрого проведения инъекции, в месте введения могут образовываться стерильные персистирующие узелки. Многие сорбированные вакцины обладают достаточной антигенностью у людей при первичной иммунизации. По времени наступления, силе и продолжительности вторичного иммунного ответа при повторной (бустерной) иммунизации различия между нативной и адъювантной вакцинами незначительные. На сегодняшний день в медицинской практике большинство вакцин содержит гидрат окиси алюминия. Это относительно слабый, но безопасный вид вакцинных адъювантов [5,8].
Минерально-масляный адъювант Фрейнда представляет собой эмульсию водного адъюванта в минеральном масле с низким удельным весом и вязкостью. При использовании такого адъюванта предварительно растворенный или суспендированный в воде антиген очень тонко диспергируют в масле. По стимуляции образования антител полный адъювант Фрейнда не имеет себе равных. Однако из-за высокой токсичности, развития лихорадки, возможности повреждения внутренних органов и формирования абсцессов в месте введения его используют только в экспериментальных целях для иммунизации лабораторных животных, но не для вакцинации людей. Использование неполного адъюванта Фрейнда в инактивированных вакцинах против гриппа и полиомиелита продемонстрировало их эффективность при низком уровне токсичности, однако недостатками этого вида вакцин, является их недостаточная стабильность [5,8,9].
Сапонин, экстрагируемый из коры южно-американского дерева Guillaja saponaria Molina, давно применяется в качестве адъюванта в ветеринарной иммунологии. Сапонин (Квил-А) является типичным представителем адъювантов — организаторов надмолекулярной структуры белковых антигенов. Установлено, что в основе адъювантного действия Квил-А лежит образование иммуностимулирующего комплекса (ИСКОМ) нового типа.
Преимущества вакцин, приготовленных по типу ИСКОМ, заключается в возможности приготовления эффективных вакцин, их стандартизации и стабилизации. Они сохраняют морфологию и иммуногенность в живом или лиофилизированном состоянии в течение трех лет [8].
На современном этапе широкое использование инновационных технологий (липосом, иммуносом), послужило толчком к разработке нового типа микрокапсулированных липосомных вакцин – Новосом. Они не вызывают образования гранулем в месте введения, а местная реакция обычно исчезает в течение двух недель. Первые экспериментальные положительные результаты получены с липосомными вакцинами против ньюкастлской болезни и других вирусных болезней птиц [8].
Механизм усиления иммунного ответа в случае использования сорбированных или эмульгированных вакцин связан с корпускулированием антигена. В такой форме антиген более эффективно захватывается макрофагами, что в свою очередь стимулирует активацию лимфоцитов. Установлено, что использованием сорбентов или эмульгаторов в вакцинах приводит к более выраженной и продолжительной пролиферации лимфоидной ткани: в месте введения вакцины и дренирующих лимфатических узлах происходит образование грануломатозных процессов.
Однако, представление об основном механизме воздействия адъювантов на иммуногенез – длительном удержании антигена в так называемом «депо» в настоящий момент претерпело значительные изменения. Механизм адьювантного действия оказался гораздо сложнее и разнообразнее и в последние годы активно изучается, а список новых адъювантов, входящих в состав вакцин, а также препаратов, обладающих иммуноадъювантными свойствами, постоянно пополняется.
В настоящее время принято считать, что основу механизма действия адъювантов составляет стимуляция каскада клеточных реакций, направленных на распознавание и ответ иммунной системы на чужеродный антиген. Одни адъюванты усиливают пролиферацию иммунокомпетентных клеток, другие стимулируют секрецию активизирующих факторов, третьи — активируют процессы дифференциации иммунокомпетентных клеток и способствуют появлению цитотоксических клеток. В клиническом аспекте применение адьювантов позволяет снизить дозу вакцинного антигена, с одной стороны, с другой – проявить высокий иммуногенный эффект у пациентов групп риска, имеющих те или иные отклонения в иммунной системе адаптивного характера (дети высокого риска инфекционной заболеваемости). Различные адъюванты могут влиять на индукцию и регуляцию синтеза различных классов антител, образование В-клеток памяти и развитие клеточного иммунитета.
В целом, механизмы действия различных иммуноадъювантов разнообразны и до настоящего времени до конца не изучены, что обусловлено различием строения, как антигенов, так и самих адъювантов.
Приоритетным направлением использования разнообразных адъювантов при вакцинации является стимуляция формирования вакцинального иммунитета у лиц с различными нарушениями в состоянии здоровья. Так, например, вакцина против вирусного гепатита В, в состав которой входит инновационная адъювантная система AS04, содержащая комбинацию монофосфорилового липида А и гидроксида аллюминия (Fendrix, GlaxoSmithKline), обладает высокой иммуногенностью в группе больных на гемодиализе, у которых обычная вакцина против гепатита В не эффективна [10]. Содержащийся в адъюванте AS04 инактивированный липополисахарид MPL имеет в своей структуре молекулярную последовательность, которая связывается с toll-подобными рецепторами (TLR)4, располагающимися на макрофагах и дендритических клетках. Активация TLR4 запускает усиленную секрецию воспалительных цитокинов и хемокинов. А сигнализация TLR не только непосредственно стимулирует врожденный иммунный ответ, но и улучшает индукцию T-хелперов (Th) и В-клеточного ответа. Кроме того, MPL выявляет способность улучшать клеточно-опосредованный иммунный ответ в виде T-хелперов и цитотоксических Т-клеток (CD8+) и является более мощным стимулятором гуморального и клеточно-опосредованного иммунитета по сравнению с гидроксидом алюминия в качестве единственного адъюванта [10].
Современная вакцина «Церварикс» против вируса папилломы человека (ВПЧ) ВПЧ-16/18 L1 VLP, содержит тот же адъювант (AS04). Согласно результатам исследований, иммунный ответ, индуцируемый вакциной, был сильнее в 1,6-3,2 раза (р Многочисленные исследования по изучению адъювантных свойств лекарственных препаратов, обладающих иммуномодулирующей активностью демонстрируют их стимулирующее влияние на иммуногенность вакцин. Установлено, что использование препаратов с иммуномодулирующей активностью на фоне вакцинации изменяет баланс эндогенных цитокинов в организме и оказывает влияние на развитие антигенспецифического иммунного ответа.
Вещества, обладающие иммуномодулирующей активностью, можно разделить на три группы: эндогенные, экзогенные и синтетические. К иммуномодуляторам первой группы относятся иммунорегуляторные пептиды и цитокины, второй группы – вещества микробного происхождения, в основном грибкового и бактериального. При этом воздействие иммуномодуляторов на иммунную систему заключается в способности как вызывать развитие иммунного ответа, так и регулировать его дальнейшее развитие. Наиболее характерными представителями адъювантов второго типа являются О-антигены, или липосахаридные эндотоксины грамположительных бактерий, играющие роль адъювантов для других антигенов, одновременно присутствующих в данной вакцине. Усиливающий эффект одного из антигенов (например, возбудителя коклюша) часто учитывают при вакцинации детей комбинированными вакцинами против наиболее распространенных заболеваний (АКДС). К третьей группе относятся синтетические аналоги препаратов первых двух групп, а также вещества, полученные в результате направленного химического синтеза, например, полиэлектролиты [4,5,8].
Впервые адъювантные свойства убитых бактерий были продемонстрированы в работах Фрейнда. Несколько позднее Ледерер с соавторами показал, что именно компоненты клеточной стенки микобактерий (трипептидные моносахариды) обладают адъювантным действием. В дальнейшем были синтезированы химические аналоги мурамилдипептидов, которые в настоящий момент используются как иммуномодуляторы (ликопид), а так же входят в состав некоторых вакцин в качестве адъювантов [5]
В серии работ отечественных ученых получены убедительные данные об адъювантной активности полиоксидония, ликопида, ИРС-19, рибомунила (Харит С.М. и соавт., 2004; Учайкин В.Ф., 2000; Коровина Н.А., Заплатников Ю.Ю., 2005; Маркова Т.П., 2001).
Одним из перспективных направлений повышения эффективности вакцинации, является использование в качестве адъювантов различных цитокинов. Цитокины оказывают влияние практически на все клетки, воздействуя на большинство процессов, протекающих в организме. Они обеспечивают межклеточную кооперацию и регулируют иммунные процессы. Их активная продукция происходит в ответ на различные стимулирующие агенты, а действие неспецифично. Цитокины образуют особую сеть, модулируя экспрессию поверхностных рецепторов и индуцируя секрецию друг друга. Благодаря высокоаффинным рецепторам на клетках-мишенях они способны вызывать биологические эффекты в малых концентрациях [13, 14, 15,16].
В серии экспериментальных работ проведено исследование адъювантных свойств цитокинов и препаратов, обладающих иммуномодулирующей активностью, на экспериментальных моделях животных. Изучены адъювантные свойства таких цитокинов как IL-1b, IL-2, ФНО-?, IFN-?, IFN-?, GM-CSF в формировании поствакцинального иммунитета у экспериментальных животных при иммунизации против вирусного гепатита А, и гепатита В, бешенства, клещевого энцефалита, малярии, герпетической и других инфекций. Было установлено усиление специфического и неспецифического клеточного иммунитета, повышение уровня вируснейтрализующих антител в сыворотке крови. Наиболее выраженный иммуностимулирующий эффект был выявлен у рекомбинантных цитокинов – фактора некроза опухоли-? и интерлейкина-1?, а также у препаратов «Полиоксидоний» и «Имунофан» [13,14,16,17].
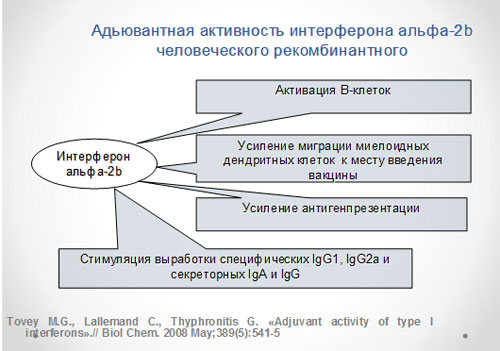
Интерфероны (ИФНы) первого типа, в частности ИФН-альфа, обладают широким спектром активности и успешно применяются как терапевтические препараты. Именно благодаря своему иммуномодулирующему эффекту, они могут выступать в качестве адъювантов вакцинных препаратов. Иммуномодулирующая активность ИФН-альфа, выражается в способности стимулировать пролиферацию и созревание дендритных клеток, на поверхности которых усиливается экспрессия молекул главного гистосовместимости класса I и других костимулирующих молекул, что в свою очередь приводит к активации специфических цитотоксических CD8+Т-лимфоцитов [18,19]. Все указанные качества являются идеальными для вакцинного адъюванта (рис.1).
Рис.1 Адъювантная активность ИФН-альфа 2b
В последние годы в литературе появилось множество работ по исследованию возможности применения ИФН-альфа в качестве адъюванта вакцинных препаратов: с момента первых публикаций Grob PJ и соавт. в 1984 году и до настоящего времени в литературе найдено более 700 публикаций на тему исследования возможности применения ИФН-альфа в качестве вакцинного адъюванта [20]. Подавляющее количество работ посвящено поиску способов усиления иммунного ответа на вакцинацию у иммунокомпрометированных пациентов (пациенты с онкологическими и аутоиммунными заболеваниями), что довольно логично, поскольку иммунный ответ на вакцинацию у здоровых людей детально изучен, предсказуем и не требует активации. Во многих публикациях показано, что применение ИФН-альфа при вакцинации белковыми и ДНК-содержащими вакцинами способствует усилению иммунного ответа, однако в отношении аденовирус-векторных вакцин нет однозначного мнения о пользе применения ИФН-альфа [21,22].
В экспериментальных исследованиях установлена адъювантная активность ИФН-? в комбинации с гриппозной вакциной при внутримышечном введении [23]. Исследования с использованием трансгенных мышей показали, что клетки, активированные интерфероном и обладающие фенотипом, характерным для миелоидных дендритных клеток, появляются в периферической крови мышей уже через 4 часа после введения гриппозной вакцины. Введение рекомбинантного ИФН-? через слизистую ротовой полости и путем внутрибрюшинной инъекции также усиливало гуморальный ответ на одновременно с этим проведенную противогриппозную вакцинацию, несмотря на то, что ИФН был введен независимо от вакцины. Введение ИФН-? через слизистую ротовой полости значительно повышало уровень вирус-специфических IgG1 и IgG2а, характерных для смешанного Th1/Th2 ответа, а также уровень секреторных IgА, связанных с резистентностью к инфекции. При введении ИФН-? одновременно с вакцинацией, но независимо от нее по месту введения, количество интерферон-активированных миелоидных дендритных клеток, выявляемых в периферической крови, было сопоставимо с таковым при внутримышечном введении вакцины с добавлением к ней ИФН-?. Анализ экспрессии показал, что в лимфоидной ткани животных, получавших интерферон, было индуцировано множество отвечающих на него генов, включая гены хемокинов и рецепторов хемокинов. Это связано с тем, что транспорт антигенпрезинтирующих клеток в место введения вакцины может частично объяснить механизмы адъювантной активности интерферона альфа [24]
Таким образом, одним из перспективных направлений современной вакцинологии является обеспечение адекватного иммунного ответа при вакцинации. Использование препаратов с иммуномодулирующей активностью на фоне вакцинации может изменять баланс эндогенных цитокинов в организме и оказывать влияние на развитие антигенспецифического иммунного ответа (Акользина С.Е., 1996; Авдеева Ж.И. 2007, Кетлинский С.А., Симбирцев А.С., 2008). В связи с этим цитокины, регулирующие каскад иммунных реакций на любое антигенное воздействие, можно рассматривать как потенциальные иммуноадъюванты. Многочисленные экспериментальные данные и отдельные клинические наблюдения свидетельствуют о высокой эффективности использования цитокинов в качестве адъювантов [13,14,16,17].
Современной реальностью и перспективой отечественной вакцинологии, о чем свидетельствуют наши собственные исследования [19, 25,26,27,28], является применение препарата рекомбинантного альфа-2 интерферона (виферон) в качестве дополнительного компонента к вакцинам у детей высокого риска заболеваемости (часто болеющие дети, дети с аллергопатологией, хроническими очагами ЛОР-патологии и дети, проживающие в регионах высокой антропогенной и техногенной нагрузки).
Литература:
1. Учайкин В.Ф., Шамшева О.В. Вакцинопрофилактика. Настоящее и будущее. // М.: ГЭОТАР-Медиа, 2001. – С. 399.
2. Tovey MG, Lallemand C, Thyphronitis G. Adjuvant activity of type I interferons. // Biol Chem. – 2008. – May. – 389(5). – p. 541-5,
3. Miquilena-Colina ME, Lozano-Rodr?guez T, Garc?a-Pozo L et all. Recombinant interferon-alpha2b improves immune response to hepatitis B vaccination in haemodialysis patients: results of a randomised clinical trial.// Vaccine. – 2009. – Sep 18;27(41). – р. 5654-60.
4. Vogel FR, Hem SL. Immunologic Adjuvants //Vaccines. 4th ed. Philadelphia, PA: Saunders. – 2004. – р. 69-79.
5. Artenstein, Andrew W. «Vaccines: A Biography».// 1st Edition., 2010.
6. Ramon G. Sur l’aumentation anormale de l’antitoxine chez les chevaux producteurs de serum antidiphterique. // Bull Soc Centr Med Vet. – 1925. – 101. – р. 227-34.
7. Glenny A, Pope C, Waddington H, Wallace V. The antigenic value of toxoid precipitated by potassium-alum. // J Path Bacteriol. – 1926. – 29. – р. 38-45.
8. Виды адъювантов http:// meduniver.com/ Medical/Microbiology/957.html
9. Freund J, Casals J, Hosmer E. Sensitization and antibody formation after injectin of tubercle bacilli and parafin oil // Proc Soc Exp Biol Med. – 1937. – 37. – р. 509-13.
10. Tino F. Schwarz. Кандидатная вакцина против вируса папилломы человека (ВПЧ) с адъювантом AS04 и ее влияние на заболеваемость раком шейки матки http://health-ua.com/articles/2163.html
11. Dubensky TW Jr, Reed SG. Adjuvants for cancer vaccines// Semin Immunol. – 2010. – Jun. – 22(3). – р. 155-61.
12. Роговская С.И. Вакцины против вируса папилломы человека: новые возможности профилактики цервикального рака (В помощь практикующему врачу) // Consilium medicum /Гинекология. – 2007. – Т. 9, № 1. – С. 26-29.
13. Акользина С.Е. Цитокины в вакцинах и их адъювантное действие.//Автореф. дис. … канд. мед. наук. М. – 1996. – 20 с.
14. Авдеева Ж.И., Акользина С.Е., Алпатова Н.А., Медуницын Н.В. Цитокины и вакцины // Тихоокеанский медицинский журнал. – 2009. – № 3. – С. 22-27.
15. Кетлинский С.А., Симбирцев А.С. Цитокины. // СПб. – Фолиант. – 2008. – 554 с.
16. Medunitsin N.V., Avdeeva J.I., Acolzina S.E. et.al. Presence of cytokines in biological preparations // Biological. – 2002. – №30. – P. 1-6.
17. Senda T. Structure and function of cytokines and receptions // Protein Nucl. Acid and Enzyme. – 1999. – Vol. 44, No. 4. – P. 318–324.
18. Малиновская В.В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и педиатрии при инфекционной патологии // Российский вестник перинатологии и педиатрии. – 1999. – Т. 44, №3. – С. 36-43.
19. Каряева С.К. Иммунопрофилактика гриппа и других ОРВИ у детей проживающих в условиях техногенного воздействия промышленного города // Автореф. дис. … канд. мед. наук. М. – 2011. – c.24.
20. Toporovski R, Morrow MP, Weiner DB. Interferons as potential adjuvants in prophylactic vaccines.//Expert Opin Biol Ther. – 2010. – Oct. – 10(10). – Р.1489-500.
21. Sikora AG, Jaffarzad N, Hailemichael Y, et all. IFN-alpha enhances peptide vaccine-induced CD8+ T cell numbers, effector function, and antitumor activity.// J Immunol. – 2009. – Jun 15. – 182(12). – P. 7398-407.
22. O’Brien L, Perkins S, Williams A , et all. Alpha interferon as an adenovirus-vectored vaccine adjuvant and antiviral in Venezuelan equine encephalitis virus infection.//J Gen Virol. – 2009. – Apr. – 90(Pt 4). – P. 874-82.
23. Robert B. Couch, Robert L. Atmar, Thomas R. Cate et all. Contrasting Effects of Type I Interferon as a Mucosal Adjuvant for Influenza Vaccine in Mice and Humans.// Vaccine. – 2009. – August 27. – 27(39). – P. 5344–5348.
24. Prchal M, Pilz A, Simma O, Lingnau K. et all. Type I interferons as mediators of immune adjuvants for T- and B cell-dependent acquired immunity.// Vaccine. – 2009. – Dec 30. – 27 Suppl 6. – P.17-20.
25. Чеботарева Т.А. Усовершенствованный метод профилактики гриппа и других ОРВИ у детей/ Детские инфекции № 2, 2004, с.34-37.
26. Чеботарева Т .А., Мазанкова Л.Н., Малиновская В.В., Каряева С.К., Лазарев В. В.Клиническая эффективность профилактики гриппа и других ОРВИ у детей, проживающих в районе экологического неблагополучия // Педиатрия. – 2009. – №6. – С. 104-111.
27. Каряева С.К., Чеботарева Т .А., Лазарев В.В. Оптимизация профилактики гриппа и других ОРВИ у детей / Материалы XIV конгресса педиатров России “Актуальные проблемы педиатрии”. Москва. – 2010. – №348 – С. 350.
28. Сhebotareva T., Karyaeva S., Malinovskaya V., Lazarev V. Modern possibilities of the efficient preventive maintenances of influenza and other ARVI in children // 14th International Congress on Infectious Diseases (ICID) MIAMI, FLORIDA. USA. – 2010. – Final Abstract Number: ISE.312.