Захарова И.Н., Малиновская В.В., Коровина Н.А., Курбанова Х.И., Глухарева Н.С., Короид Н.В.
ГОУ ДПО Российская медицинская академия последипломного образования Росздрава.
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН.
Тушинская детская городская больница г. Москвы (гл. врач Куликова О.Е.).
Широкий спектр противовирусной активности интерферонов обусловливают целесообразность их применения при ОРВИ. Показано, что противовирусные и антибактериальные свойства интерферона проявляются как при системном, так и при местном их применении. Установленная клиническая эффективность местной виферонотерапии сопровождается изменениями цитокинового статуса слизистой носа, определяемого в назальных смывах. Динамика показателей местного иммунного ответа при использовании ВИФЕРОНА зависит от возраста детей, тяжести заболевания, клинических форм респираторного синдрома, наличия бактериальных осложнений, выраженности и характера вирусной контаминации.
Широкое распространение острых респираторно-вирусных инфекций (ОРВИ) (более 70% от всей инфекционной патологии, регистрируемой у детей), рост заболеваемости, несмотря на успехи специфической профилактики гриппа, частота тяжелых форм и неблагоприятных исходов у детей требуют постоянного совершенствования профилактических и лечебных мероприятий [1-6]. Роль системы интерферона (ИФН) в патогенезе ОРВИ обусловливают целесообразность применения препаратов на его основе в лечебных целях [7-13].
За полувековую историю развития учения о системе ИФН детально исследованы неспецифические и специфические механизмы ее функционирования [14]. ИНФ вырабатываются всеми клетками организма, но 99% их образуются клетками крови и костного мозга. Под действием ИФН происходит усиление презентации вирусных антигенов путем усиления экспрессии генов главного комплекса гистосовместимости и стимуляции созревания антигенпрезентирующих клеток [15, 16]. ИФН относятся к числу факторов, контролирующих развитие иммунного ответа типа Th1 и повышающих жизнеспособность и пролиферативную активность Т-клеток [17, 18]. Интерферон-гамма (ИФН-?) индуцирует и стимулирует продукцию провоспалительных цитокинов: фактора некроза опухоли альфа (ФНО-?), интерлейкинов (ИЛ-1, ИЛ-6). ИФН-? является специализированным индуктором активации макрофагов, способным увеличивать экспрессию более ста разных генов в геноме макрофагов, в результате чего макрофаги приобретают способность лизировать вирус-инфицированные клетки [19, 20]. Под влиянием ИФН-? происходит усиление фагоцитоза и антител-опосредованной цитотоксичности макрофагов. ИФН-альфа (ИФН-?) играет важную роль в формировании, как клинических проявлений респираторных инфекций, так и механизмов защиты от патогенных вирусов [21, 22]. Контроль уровня ИФН-? в сыворотке крови позволяет прогнозировать эффективность лечения и исход заболевания. Отсроченная или сниженная продукция эндогенного ИФН может привести к прогрессированию вирусной инфекции. Известно, что у лиц с низким уровнем циркулирующего ИФН грипп протекает значительно тяжелее и с большим числом осложнений, чем у больных с высокими титрами ИФН [23].
В терапии острых респираторных заболеваний в настоящее время все чаще применяются препараты интерферонов. Есть данные, свидетельствующие, что противовирусные и антибактериальные свойства интерферона проявляются как при системном, так и при местном их применении [24 – 27].
Материалы и методы исследования. С целью оценки эффективности лечения детей раннего возраста, больных острыми респираторными вирусными инфекциями, в комплексной терапии использовался местно в виде мази препарат ВИФЕРОН – интерферон человеческий рекомбинантный альфа – 2. Препарат обладает выраженными противовирусными, антипролиферативными и иммуномодулирующими свойствами. Регистрационный номер: PN001142/01. в одном грамме мази для наружного и местного применения содержится интерферон альфа – 2 человеческий рекомбинантный 40000 МЕ и вспомогательные вещества (токоферола ацетат0,02 г, ланолин безводный0,34 г, вазелин медицинский0,45 г, масло персиковое0,12 г, вода очищенная до1,0 г).
Для лечения ОРВИ у детей вначале очищали полость носа от слизи и корочек путем высмаркивания или промывания носа физиологическим раствором, затем наносили мазь на слизистую оболочку носа, выдавив из тубы горошину мази размером 0,5см 3-4 раза в сутки. Детям от 1 года до 2-х лет – 2500 МЕ (1 горошина диаметром0,5 см) 3 раза в сутки, детям от 2-х до 6 лет 2500 МЕ (1 горошина диаметром0,5 см) 4 раза в сутки. Длительность лечения составила 5 дней.
Под нашим наблюдением находились 100 больных ОРВИ в возрасте от 1 года до 6 лет, в том числе 57 мальчиков (57%) и 43 девочки (43%). Все пациенты были госпитализированы в первые 48 часов от начала заболевания в специализированное отделение для больных острой респираторно-вирусной инфекцией. В соответствии с проводимым рандомизированным двойным слепым, плацебо – контролируемым исследованием, исследуемые пациенты были разделены на две группы: основная – 60 больных, которые помимо базисной терапии по поводу ОРВИ получали препарат ВИФЕРОН (мазь), группа сравнения – 40 больных, которые получали плацебо.
Для обследования детей, больных ОРВИ, наряду с общепринятыми клинико-лабораторными методами, использовались специальные методы исследования: вирусологическое (с целью этиологической расшифровки болезни) и иммунологическое (изучались показатели интерферонового и цитокинового статуса, факторы мукоцилиарной защиты носоглотки путем определения уровней секреторного Ig A в назальном секрете). Показатели иммунного и интерферонового статусов исследовали дважды: в острый период заболевания (1–2 день болезни) и в период реконвалесценции (6–7 день болезни).
Результаты исследования. Лечение больных ОРВИ проводилось на ранних сроках заболевания. Наблюдаемые группы были равноценными по своей клинической характеристике (тяжести заболевания, частоте клинических форм респираторного синдрома и осложнений), что является важным условием для получения достоверных результатов исследования. При наблюдении в клинике оценивалась выраженность и длительность симптомов интоксикации и респираторного синдрома. Основные симптомы ОРВИ были связаны с общей интоксикацией организма (повышение температуры, снижение аппетита, вялость, бледность уменьшение двигательной активности) и поражением дыхательных путей (ринит, кашель, осиплость голоса, одышка, дыхательная недостаточность).
Интоксикация у большинства пациентов проявлялась снижением аппетита – у 90% детей, вялостью – у 89%, бледностью кожных покровов – у 89% и снижением двигательной активности – у 84%. Лихорадка отмечалась в 93% случаев, при этом почти у половины из них (у 45 детей) температура была выше 38о.
Респираторный синдром с разной выраженностью его проявлений был зарегистрирован при поступлении в стационар у 100% больных. Проявление воспаления слизистой носа отмечалось в виде отека (5%), слизистого (94%) и гнойного отделяемого (1%). Гиперемия ротоглотки имела место во всех случаях (100%). У значительной части больных ОРВИ (88%) наблюдался кашель, который, в основном, характеризовал непродуктивное воспаление: сухой кашель был у 68%, малопродуктивный – у 12% и лающий – у 1 больного. У 7% детей кашель сопровождался отхождением мокроты и у 2 из них выслушивались влажные хрипы в легких. Одышка (чаще экспираторного характера) отмечалась у 22% больных.
Диагноз ОРВИ устанавливался на основании характерных клинических проявлений и эпидемиологических данных, а у 89% детей удалось уточнить этиологию заболевания: аденовирусная инфекция у 12,4%, парагриппозная инфекция – у 6,7%, респираторно-синцитиальная (РС инфекция) – у 12,4%, риновирусная инфекция – 18%, смешанная инфекция – у 50,6% больных в различных сочетаниях. У 10% больных удалось доказать участие более 3-х возбудителей. Этиологическая структура ОРВИ по группам наблюдения была, в основном, одинаковой.
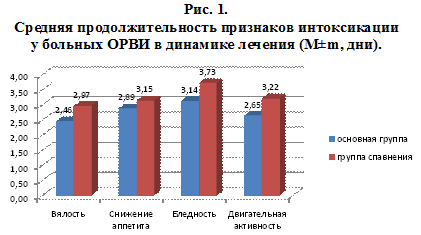
В группе больных, получавших ВИФЕРОН (мазь), средняя продолжительность большинства клинических проявлений симптомов интоксикации (вялость, бледность, двигательная активность) была меньше, чем у больных из группы, получавших плацебо – 2,46±1,1 суток против 2,97±0,9 суток, 3,14±0,5 суток против 3,73±1,05 суток и 2,65±1,0 суток против 3,22±1,15 суток (соответственно). Менее различалась средняя продолжительность снижения аппетита (рис.1).
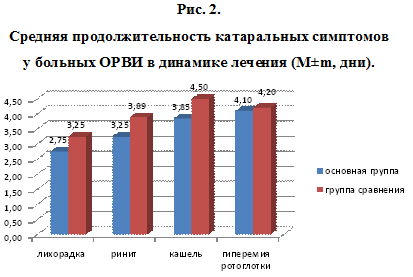
Динамика других клинических симптомов ОРВИ (лихорадка, ринит, кашель, гиперемия зева) так же происходила по-разному по группам наблюдения. Так, длительность лихорадки при течении ОРВИ в среднем по группам составляла: основная группа – 2,75±0,4 суток, сравнения – 3,25±0,6 суток (р>0,05). При анализе средней максимальной температуры у наблюдаемых больных указанная температура тела отмечалась только в первые сутки терапии, причем, в основной группе 38,6 ± 1,2, в группе сравнения – 38,5±1,2 (рис.2).
Признаки ринита наблюдались в течение более продолжительного времени, нежели чем лихорадка. Средняя продолжительность ринита также была меньше у больных ОРВИ, в лечение которых был включен ВИФЕРОН, – 3,25±0,98 суток против 3,89±1,0 суток при использовании плацебо, хотя различия были недостоверными (р>0,05). Менее всего ВИФЕРОН оказал влияние на среднюю продолжительность гиперемии зева. В основной группе больных продолжительность данного клинического симптома составляла 4,1±0,7 суток, в группе сравнения – 4,2±0,8 суток (р>0,05).
Средняя продолжительность кашля при использовании ВИФЕРОНА, в среднем, составляла 3,85±1,1 суток, при плацебо – 4,5±1,0 суток (р>0,05). Анализируя динамику кашля, нами установлено достоверное сокращение длительности сухого кашля – 1,25±0,14 суток в основной группе против 1,95±0,22 суток в группе сравнения (р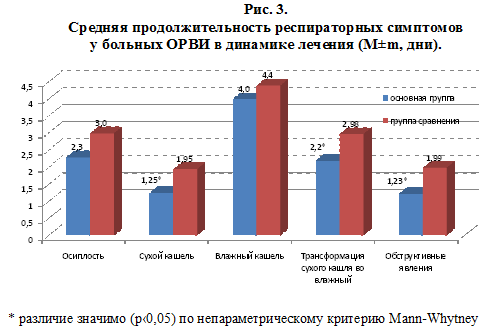
Особо следует отметить тенденцию положительного влияния препарата ВИФЕРОН на продолжительность осиплости голоса. Купирование данного симптома отмечалось на 15 часов быстрее, нежели чем в группе сравнения. По средним показателям в основной группе детей продолжительность осиплости голоса была 2,3±0,23 суток, а в группе сравнения – 3,0±0,24 суток (p>0,05). Хотя выявленные различия не носят достоверный характер, все же это имеет большое практическое значение, так как осиплость голоса является одним из первых предвестников развития такого угрожающего для жизни состояния как круп.
Для оценки влияния лечения Вифероном (мазь) на элиминацию этиологически значимых вирусов из носоглотки оценивалось их исчезновение после терапии. В основной группе детей элиминация вирусов была зарегистрирована в 85,2% случаев, в группе сравнения – в 37,1% случаев. Получены достоверные различия в элиминации этиологически значимых вирусов, как при варианте моно- (90,1% против 18,2%), так и при варианте микстинфекции (76,2% против 45,8%). В основной группе отмечалась полная (100%) элиминация вируса при аденовирусной и РС-вирусной инфекции, в 83,3% случаев парагриппозной инфекции и в 81,8% случаев риновирусной инфекции.
У части детей обеих групп при исследовании смывов из носоглотки после проведенной терапии отмечена контаминация дополнительными вирусами (суперинфицирование!). Значительно реже регистрация «новых» вирусов отмечалась после терапии ВИФЕРОНОМ, мазью – у 21,7% больных, чем у детей, получавших плацебо – 57,5% больных (р Индуцированная продукция ?-ИФН у пациентов, получавших мазь ВИФЕРОН, увеличивалась в 2,5 раза в динамике (с 4,31±3,47 пкг/мл до 10,75±5,34 пкг/мл) и достоверно отличалась в периоде реконвалесценции по сравнению с детьми, получавшими плацебо (5,91±4,8 пкг/мл и 6,79±2,58 пкг/мл, соответственно) (pТаблица 1
Динамика показателей местного иммунитета у больных ОРВИ в исследуемых группах (M±m, пкг/мл)
|
Показатели |
Всего (n=100) |
Основная группа (n=60) |
Группа сравнения (n=40) |
|||
|
до лечения |
после лечения |
до лечения |
после лечения |
до лечения |
после лечения |
|
| ИФН-a |
4,46±3,6 |
8,3±4,77* |
4,31±3,47 |
10,75±5,34*/** |
5,91±4,8 |
6,79±2,58 |
| ИФН-g |
3,62±3,7 |
6,15±3,68* |
4,26±3,16 |
9,75±4,78*/** |
2,98±2,2 |
3,56±1,86 |
| ИЛ-8 |
528,0±158,4 |
454,3±167,4 |
506,13±165,7 |
458,13±161,8** |
549,9±150,3 |
651,48±170,3* |
| ФНО-a |
26,97±15,5 |
14,52±10,2* |
25,30±16,4 |
9,86±7,84*/** |
28,64±14,9 |
19,8±12,95* |
| sIg A |
8,84±6,6 |
11,3±7,7* |
8,04±6,8 |
13,2±9,17*/** |
9,64±8,4 |
10,29±5,79 |
* достоверные различия между показателями до- и после лечения, p0,05).
В динамике ОРВИ у детей, получавших мазь ВИФЕРОН, концентрация ИЛ-8 в назальных смывах изменялась незначительно (с 506,13±165,7 пкг/мл до 458,13±161,8 пкг/мл, p>0,05), тогда как на фоне плацебо она достоверно увеличивалась (с 549,9±150,3 пкг/мл до 651,48±170,3 пкг/мл, p0,05).
Влияние местной виферонотерапии на концентрацию ФНО-a в назальных смывах проявлялось в его достоверном снижении с 25,30±16,4 пкг/мл до 9,86±7,84 пкг/мл (p0,05).
У больных ОРВИ основной группы, получавших дополнительно в комплексной терапии ВИФЕРОН в виде мази, увеличение средних показателей ИФН-a, ИФН-g и sIg A в назальных смывах было достоверно значимым по сравнению с таковыми в группе больных, получавших плацебо. Так, средние значения ИФН-a к 5 дню лечения ВИФЕРОНОМ, мазью увеличились на 6,44±4,38 пкг/мл, в группе сравнения на 0,88±0,55 пкг/мл, p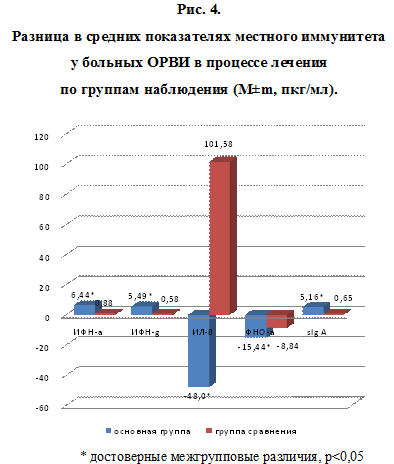
Изменения показателей ИЛ-8 и ФНО-? характеризовались снижением на 48,0±14,43 пкг/мл и 15,44±5,51 пкг/мл. При этом эта разница достоверно отличалась от таковой в группе сравнения – 101,58±24,5 пкг/мл и 8,84±5,5 пкг/мл, pЗаключение. Таким образом, ВИФЕРОН, мазь является высокоэффективным средством для лечения ОРВИ у детей, обладает адъювантными свойствами. Выявленная клиническая эффективность местной виферонотерапии сопровождалась изменениями цитокинового статуса слизистой носа, определяемого в назальных смывах. Динамика показателей местного иммунного ответа при использовании ВИФЕРОНА зависела от возраста детей, тяжести заболевания, клинических форм респираторного синдрома, наличия бактериальных осложнений, выраженности и характера вирусной контаминации.
Литература:
1. Покровский В.И. Инфекционные болезни. Новые проблемы // Терапевтический архив. – 2008. – № 8 . – С. 43-45.
2. Острые респираторные заболевания у детей: лечение и профилактика (руководство для врачей) / Под ред. Баранова А.А., Каганова Б.С., Горелова А.В. – М.: Издательский Дом «Династия», 2004. – 128 с.
3. Word Health Organization. Pandemic Preparedness, 2004 (http://www.who.int/csr /disease/influenza/pandemic/en/print/html).
4. Influenza Pandemic Plan. The Role of WHO and Guidelines for National and Regional Planning. WHO/CDS/CSR/EDC/99.1.
5. Распространение гриппа и ОРВИ в мире и РФ в эпидсезоне 2007–2008 гг. Вакцинация. – 2008. – №5. – С. 3–5.
6. Здравоохранение в России, 2009 // Статистический сборник.- М., 2009.- С.60.
7. Ершов Ф.И., Григорян С.С., Орлова Т.Г. и др. Противовирусная терапия ОРВИ у детей // Детские инфекции. – 2006. – № 3 . – С. 56-61.
8. Макарова Е.С. Доскин В.А. Малиновская В.В. и др. Применение виферона у детей раннего возраста в зависимости от сезонных ритмов интерферонообразования // Тез. докл. Росс. науч. Конгр. “Человек и лекарство”.- М., 2001.- С. 272.
9. Малиновская В.В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и педиатрии при инфекционной патологии // Российский вестник перинатологии и педиатрии.- 1999.- № 3.- С.36-43.
10. Малиновская В.В., Парфенов В.В., Макарова З.С. и др. Новые лекарственные формы виферона (человеческий рекомбинантный интерферон альфа-2b) для наружного применения // Фарматека.- 2004.- № 7.- С.48–50.
11. Нестерова И.В., Ковалева С.В. Виферон в программной иммунореабилитации часто и длительно болеющих детей // Кремлевская медицина.- 2002.- № 2.- С.65–69.
12. Чеботарева Т.А. Комбинированный метод профилактики гриппа и ОРВИ у детей // Детские инфекции.-2004.- № 2. – С.34-37.
13. Чеботарева Т.А. Тимина В.П. Малиновская В.В. Виферон: применение при гриппе и др. ОРВИ у детей / В кн.: Иммуномодулирующий и противовирусный препарат виферон в лечении детей и взрослых, часто болеющих вирусно-бактериальными инфекциями.- М.: ИНКО-ТНК, 2003.- 30с.
14. Адольф Г. Биология системы интерферона // Мат. симп. “Исследования в области генной инженерии на фирме Берингер- Ингель- Хайм”.- 1993.- С.1-8.
15. Авдеева Ж.И., Медуницин Н.В., Крылов О.Р. и др. Влияние препаратов интерферона на уровень экспрессии АГ 2 класса главного комплекса гистосовместимости на клетках крови человека // Иммунология.- 1987. – №4.- С.82-85.
16. Biron C.A. Interferons ? ? as immune regulators – a new look // Immunity.- 2001.- Vol. 14.- P.661-664.
17. Nguyen D.N., Kim P., Mart?nez-Sobrido L. et al. A novel high-throughput cell-based method for integrated quantification of type I interferons and in vitro screening of immunostimulatory RNA drug delivery // Biotechnol Bioeng.- 2009.- N 103(4).- P.664-675.
18. Bekisz J., Baron S., Balinsky C. et al. Antiproliferative Properties of Type I and Type II Interferon // Pharmaceuticals (Basel).- 2010.- N 3(4).- P.994-1015.
19. Assenmacher M., Schefold A., Schmitz J. et al. Specific expression of interferon- gamma on interferon-gamma producing T cells from mouse and man // Eur.-J.-Immunool.-1996.-Jan.-Vol.26.-N.1.- P.263-267.
20. Dehlin E., Gabain A et al. Repression of beta interferon qene expression in virus-infected is correlated with a poly (A) tail elongation // Mol. Cell. -Biol.-1996.-Feb.-Vol.16.- N 2.- P.468-474.
21. Leventhal B., Kashima H., Mounts P. et al. Long-term response of recurrent respiratory papillomatosis to treatment with lymphoblastoid interferon alfa-N1 // New England Journal of Medicine.- 1991.- N 325.- P.613–617.
22. Oba M., Yano S., Shuto T. et al. IFN-gamma down-regulates Hsp27 and enhances hyperthermia-induced tumor cell death in vitro and tumor suppression in vivo // Int J Oncol.- 2008.- N 32(6).- P.1317-1324.
23. Блинников И.Ю. Патогенетические основы применения реаферона в оздоровлении часто болеющих детей:. Автореф. дис. … канд. мед. наук.-Казань, 1995.- 17с.
24. Гатич Р.З., Колобухина Л.В., Исаева Е.И. и др. Эффективность Виферона при гриппе у взрослых больных // Русский медицинский журнал.- 2004. № 14.-С.898-902.
25. Ершов Ф.И., Григорян С.С., Орлова Т.Г. и др. Противовирусная терапия ОРВИ у детей // Детские инфекции. – 2006. – № 3 . – С. 56-61.
26. Chen Q., Zhang L.L., Yu D.X. et al. A field trial for evaluating the safety of recombinant human interferon alpha-2b for nasal spray // Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi.- 2005.- N 19(3).- P.211-215.
27. Chon T.W., Bixler S. Interferon-tau: current applications and potential in antiviral therapy // J Interferon Cytokine Res.- 2010.- N Jul;30(7).- P.477-485.